Aplicación de electrólisis con adición de sales para remoción de color en potabilización de agua
Electrolytic process applied with addition of salts for color removal in drinking water treatment
Aplicação de eletrólise com adição de sais para remoção de cor em potabilização de águaz
Gustavo Moreira-Colletti*, Edson Pereira-Tangerino**, Iván Andrés Sánchez-Ortiz***
* Universidade Estadual Paulista "Júlio de Mesquita Filho" (Ilha Solteira - São Paulo, Brasil).
** Ph. D. Universidade Estadual Paulista "Júlio de Mesquita Filho" (Ilha Solteira - São Paulo, Brasil). edtang@feis.unesp.br.
*** M.Sc. Universidad de Nariño (Pasto - Nariño, Colombia). iaso@udenar.edu.co.
Fecha de recepción: 6 de enero de 2016 Fecha de aprobación: 11 de abril de 2016
Resumen
Se evaluó el proceso electrolítico como etapa de tratamiento para la potabilización de agua del lago del barrio Ipê (Ilha Solteira -São Paulo, Brasil-). Se determinó la eficiencia del tratamiento para la remoción de color aparente y verdadero sobre muestras a las que se adicionaron sustancias húmicas para alcanzar diversos niveles de color. Se evaluó el efecto individual de la adición de 1 g/L de NaCl y de TiO2. Para cada ensayo se calculó la eficiencia de remoción a partir de muestras tomadas del reactor electrolítico en intervalos de 10 minutos durante una hora. Para agua con color aparente inicial de 25 uH se redujo hasta 15uH -nivel máximo permitido por la norma brasilera de agua potable- en 30 minutos de reacción; para agua con 66 uH de color aparente, con adición de sal, se redujo hasta 13 uH en el término de una hora. En los ensayos con adición de sustancias húmicas, la remoción de color aparente para agua con 708 y 247 uH fue, respectivamente, de 87.3 y 84.2% después de 60 minutos de reacción. Los resultados mostraron el desempeño del tratamiento electrolítico con uso de sales como etapa de potabilización del agua, tanto para alcanzar los niveles de color aparente establecidos por la legislación, como para su remoción hasta ciertos niveles; etapa de tratamiento que ha de ser complementada por otras posteriores.
Palabras clave: agua potable; electrólisis; potabilización; remoción de color.
Abstract
In this paper the electrolytic process application as a water purification treatment stage from the Ipê neighborhood lake (Ilha Solteira -São Paulo, Brazil-) was evaluated. The treatment efficiency for apparent and true color removal, in samples by addition of humic substances, to reach different colors levels was determined. It was monitored the 1 g/L NaCl and TiO2 addition individual effect. The removal efficiency for each trial in samples taken from the electrolytic reactor each 10 minutes during one hour, were calculated.
For the water sample with initial apparent color of 25 Hu, it was reduced up to 15 Hu -maximum permitted value according the Brazilian drinking water guidelines- after 30 reaction minutes. For the apparent water color with 66 Hu, with sodium chloride addition, a reduction up to 13 Hu was measured after one hour reaction. In the trials with humic substances addition, the apparent color removal for water with 708 and 247 Hu, were 87.3% and 84.2%, respectively, after 60 minutes of reaction.
The results showed the electrolytic process performance with use of salts as a drinking water treatment stage, both for the apparent color reduction below the maximum permitted values defined by the legislation, as for its removal up to certain levels; treatment stage that should be complemented by additional stages.
Keywords: color removal; drinking water; electrolysis; purification treatment.
Resumo
Avaliou-se o processo eletrolítico como etapa de tratamento para a potabilização de água do lago do bairro Ipê (Ilha Solteira -São Paulo, Brasil-). Determinou-se a eficiência do tratamento para a remoção de cor aparente e verdadeira sobre amostras às que se adicionaram substâncias húmicas para alcançar diversos níveis de cor. Avaliou-se o efeito individual da adição de 1 g/L de NaCl e de TiO2. Para cada ensaio calculou-se a eficiência de remoção a partir de amostras tomadas do reator eletrolítico em intervalos de 10 minutos durante uma hora. Para água com cor aparente inicial de 25 uH reduziu-se até 15uH -nível máximo permitido pela norma brasileira de água potável- em 30 minutos de reação; para água com 66 uH de cor aparente, com adição de sal, reduziu-se até 13 uH no período de uma hora. Nos ensaios com adição de substâncias húmicas, a remoção de cor aparente para água com 708 e 247 uH foi, respectivamente, de 87.3 e 84.2% depois de 60 minutos de reação. Os resultados mostraram o desempenho do tratamento eletrolítico com uso de sais como etapa de potabilização da água, tanto para alcançar os níveis de cor aparente estabelecidos pela legislação, como para sua remoção até certos níveis; etapa de tratamento que tem de ser complementada por outras posteriores.
Palavras chave: água potável; eletrólise; potabilização; remoção de cor.
I. Introducción
El uso del agua para consumo humano es considerado su fin más noble y prioritario, toda vez que el ser humano depende de una oferta adecuada del líquido para su sobrevivencia y mantenimiento de la calidad de vida. Desde hace por lo menos un siglo, la demanda de consumo público de agua de abastecimiento ha experimentado un crecimiento a un ritmo mucho más rápido que el crecimiento de la población, y esta tendencia se mantiene. En ese periodo, la población se cuadruplicó, mientras que el consumo de agua creció siete veces [1].
El agua potable y el saneamiento constituyen algunos de los motores más poderosos del desarrollo humano, pues ensanchan las oportunidades, aumentan la dignidad y ayudan a crear un ciclo virtuoso de mejoría de la salud y de crecimiento de la riqueza [2].
El tratamiento que permite adecuar el agua cruda< afluente a una planta de tratamiento consiste, básicamente, en remover partículas en suspensión y coloidales, materia orgánica, microorganismos y otras sustancias posiblemente deletéreas a la salud humana presentes en el líquido [3].
Desde el punto de vista tecnológico, agua de cualquier calidad puede ser, en principio, transformada en agua potable; sin embargo, los costos involucrados y la confiabilidad en la operación y mantenimiento pueden inviabilizar el uso de un determinado cuerpo de agua como fuente de abastecimiento. Existe una relación intrínseca entre el medioambiente y las tecnologías de tratamiento, esto es, en función de la calidad del agua de una determinada fuente y de sus relaciones con el medioambiente, hay tecnologías específicas para que el tratamiento sea efectivamente realizado [4].
Los cambios de difícil predicción en el clima, sumados al marcado deterioro de las cuencas hidrográficas por causa de la contaminación y la deforestación, aumentan la posibilidad de alteraciones repentinas en la calidad del agua de las fuentes utilizadas para abastecimiento de la población, exigiendo métodos complementarios para su tratamiento y, en casos extremos, la suspensión del suministro de agua [5].
Entre los parámetros que sufren las más drásticas variaciones en la época de lluvias son el color y la turbidez, ambos de gran importancia ambiental y sanitaria, e íntimamente relacionados. El color de una muestra de agua está asociado al grado de reducción de intensidad que la luz sufre al atravesarla, debido a la presencia de sólidos disueltos, principalmente material coloidal orgánico e inorgánico. Entre los coloides orgánicos pueden mencionarse los ácidos húmico y fúlvico, sustancias naturales resultantes de la descomposición parcial del compuesto presente en hojas, entre otros sustratos [6]. Se denomina color aparente aquel que presenta el agua cruda en su condición natural, y color verdadero el que queda después de que el agua ha sido filtrada [7].
En sistemas de potabilización que realizan la desinfección mediante adición de cloro cobra gran importancia la remoción de la materia orgánica de origen natural, pues como resultado de la cloración de precursores orgánicos naturales -como las sustancias húmicas- se forman subproductos de la desinfección cuyos principales representantes son los trihalometanos, los ácidos haloacéticos, las halocetonas y los haloacetonitrilos [8].
Los trihalometanos más comúnmente encontrados en el agua potable son el cloroformo, el bromodiclorometano, el dibromoclorometano y el bromoformo [9]; de los cuales, tanto el cloroformo como el bromodiclorometano han sido clasificados por la International Agency for Research on Cancer como posiblemente cancerígenos para humanos [10].
Entre los factores que afectan la formación de los subproductos de la desinfección se encuentran los parámetros de la calidad del agua bruta, principalmente la presencia de materia orgánica natural y de iones bromuro, así como algunos parámetros operacionales tales como pH, temperatura, dosis de desinfectante y tiempo de contacto [11].
Particularmente para el caso de los trihalometanos, su formación puede reducirse mediante la remoción de sus precursores antes de su contacto con el cloro, lo cual podría lograrse con opciones de tratamiento tales como: coagulación y sedimentación, con variaciones como coagulación mejorada, flotación por aire disuelto y adsorción; ozonización junto con carbón activado granular en la fase de adsorción, o a través de separación por membranas en el rango de ultrafiltración y nanofiltración [8,10].
Como puede observarse, la remoción de color del agua es una etapa extremadamente importante del tratamiento del líquido para consumo humano, pues además de brindar un carácter estético al líquido - relacionado con la aceptabilidad del consumidor-, evita la eventual generación de subproductos que puedan afectar la salud de los usuarios.
El desafío de la creciente demanda por calidad en el agua solamente podrá superarse si se aplican las técnicas científicas y tecnológicas disponibles y apropiadas para incrementar la productividad del proceso tecnológico que permita convertir agua de baja calidad en líquido adecuado para su uso específico [12]. Dada la amplia gama de niveles de color del agua a ser tratada con fines potables, y considerando las múltiples especificidades y la variabilidad de estas de cada caso, cobra importancia el estudio de opciones de tratamiento alternativas para la remoción del parámetro.
La electrólisis consiste, básicamente, en la separación de sustancias por medio del uso de la electricidad. La aplicación de un potencial eléctrico entre dos electrodos causa una corriente eléctrica que pasa a través de la solución y, a su vez, causa la migración de cationes hacia el electrodo negativo, y de aniones hacia el electrodo positivo [13]. Un reactor, o celda, electrolítico tiene dos electrodos sumergidos en sal fundida o en una solución donde la reacción es propiciada por una batería externa o por cualquier otra fuente de corriente continua; dicha fuente actúa como una bomba de electrones, impulsando los electrones hacia un electrodo y retirando los del otro. En la electrólisis de la sal común los iones Na+ reciben< electrones del electrodo negativo, y son reducidos mientras que hay un movimiento de iones Cl-hacia el electrodo positivo, donde son oxidados.
La aplicación de los procesos electrolíticos, principalmente para el tratamiento de aguas residuales, se presentó a finales del siglo XIX en Europa, y, de manera especial, a inicios del siglo XX en Estados Unidos y Canadá, donde los objetivos iniciales de dichos trabajos se resumían en: producir sedimentos no putrescibles, evitar el desprendimiento de gases fétidos y esterilizar los vertimientos efluentes [14].
Se han realizado numerosas investigaciones e implementado sistemas de tratamiento electrolítico tendientes, entre otros, a la desinfección y la remoción de compuestos orgánicos de efluentes crudos o de diversos tipos de sistemas de tratamiento, para vertimiento final o para su reúso. Una de las aplicaciones más recientes consiste en la electrooxidación de compuestos orgánicos, que puede servir como un pretratamiento de compuestos tóxicos y no biodegradables para que estos sean posteriormente tratados por medio de sistemas biológicos convencionales [15]. Particularmente, en la última década el tratamiento electroquímico ha sido frecuentemente aplicado para la remoción de compuestos orgánicos y metales tanto de residuos líquidos como sólidos, suelos y sedimentos [16].
La electrocoagulación es un proceso de tratamiento cuyo desempeño es comparable con el de métodos convencionales, como la coagulación química. De dicho proceso se han reportado altas eficiencias de remoción de color, de demanda química de oxígeno y demanda bioquímica de oxígeno, con requisitos de tiempo menores que la coagulación tradicional y costos inferiores a los precisados por otros métodos de tratamiento, tales como la radiación ultravioleta y el ozono [17].
Con base en lo anterior, el tratamiento electrolítico presenta una potencial aplicación para la remoción de color en los procesos de tratamiento de agua proveniente de fuentes superficiales; por ello la importancia de la evaluación de dicha tecnología como fase de la potabilización del agua.
Dada la relativa complejidad y los elevados costos de la electrólisis, en comparación con el tratamiento convencional -también conocido como tratamiento en ciclo completo-, el cual incluye las etapas de pretratamiento, coagulación, floculación, sedimentación y filtración [18], podría contemplarse como una opción adicional o complementaria, posterior al tratamiento convencional.
En términos generales, la presente investigación tuvo como objetivo evaluar el desempeño del proceso electrolítico para la remoción de diversos niveles de color, tanto en condiciones naturales como por medio de la adición de sustancias húmicas para simular elevados valores de color, comunes en épocas de lluvias; finalmente, se evaluó el proceso con la adición individual de 1 g/L de cloruro de sodio y de dióxido de titanio al líquido a ser tratado.
II. Materiales y Métodos
A. Origen del agua y de las sales utilizadas
El agua de estudio utilizada en la presente investigación fue colectada en el lago del barrio Ipê, de la ciudad Ilha Solteira, estado de São Paulo, Brasil. Las muestras analizadas pasaron por un proceso de electrólisis bajo régimen potenciostático, en el que a los electrodos de aluminio se aplicaron tensiones de 25 V y corrientes entre 1 y 5 Amperios. En la mitad de los ensayos se adicionaron sales a las muestras (cloruro de sodio o dióxido de titanio), con el fin de observar el eventual efecto de estas en el rendimiento del proceso, bien sea en términos de la eficiencia de remoción del color o de la velocidad del proceso.
B. Fases de la investigación
Las colectas del agua del lago se realizaron en cuatro fechas diferentes, para registrar la variación natural de la intensidad y del tipo de agentes que proporcionan color natural al agua. El experimento constó de cuatro fases de evaluación de la eficiencia del sistema de tratamiento; a continuación, se describen brevemente las características de dichas fases:
1) Primera fase: En esta fase se mantuvieron las características naturales de color aparente y se sometió el agua al ensayo electrolítico.
2) Segunda fase: En esta fase se utilizó agua del lago con color aparente inicial del orden de 2.5 veces mayor que el valor registrado en la primera fase; se mantuvieron los niveles iniciales de este parámetro y se adicionó NaCl en una concentración de 1 g/L.
3) Tercera fase: En esta se realizó variación de color por medio de la adición de ácido húmico de origen comercial hasta registrar un color aparente por encima de las 700 uH. Se utilizaron ácidos húmicos por tratarse de la fracción reactiva más estable de las sustancias húmicas, los cuales tienen una coloración oscura, alto contenido de anillos aromáticos y grupos funcionales hidrofílicos [19];
4) Cuarta fase: En esta fase, además de utilizar ácido húmico para obtener un color aparente inicial superior a 245 uH, se adicionó TiO2 en una concentración de 1 g/L. El TiO2 ha sido principalmente usado en procesos de oxidación avanzada, específicamente en la oxidación fotocatalítica, que consiste en la destrucción de los contaminantes mediante el empleo de radiación solar ultravioleta y catalizadores -como el TiO2-, con el objeto de formar radicales hidroxilo, que tendrán un efecto oxidante sobre los contaminantes químicos [20].
C. Características del reactor electrolítico y procedimientos empleados
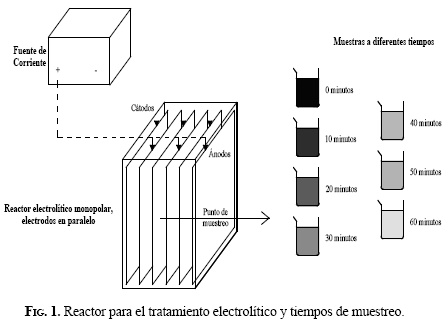
Las muestras de agua fueron sometidas al proceso de electrólisis, que se realizó en un reactor rectangular de acrílico transparente de 40 cm de longitud, 20 cm de ancho y 30 cm de altura, y un volumen útil de 20 L. Los electrodos del reactor estuvieron compuestos por 4 placas de aluminio de 30 cm de altura, 35 cm de longitud y 2 mm de espesor. Se utilizó una fuente alimentadora de corriente continua, marca Labo, modelo FR 25 50, rectificadora, con 25 voltios nominales y corriente máxima de 5 amperios. Para el sistema eléctrico se utilizaron cables y caimanes N.° 10. En la Figura 1 se presenta una imagen en la que se ilustran los principales elementos constitutivos del sistema utilizado en el experimento.
D. Procedimientos empleados
Los procedimientos adoptados en los ensayos se describen brevemente a continuación:
III. Resultados
A. Fase 1, agua del lago de Ipê
Los valores del voltaje y del amperaje inicialmente establecidos, de 20 V y 0,75 A, se mantuvieron estables a lo largo del experimento. Para el agua evaluada en esta etapa, con color aparente y verdadero iniciales de 25 y 10 uH, respectivamente, se observó que después de 30 minutos de reacción se redujo el color aparente hasta alcanzar el nivel máximo permitido para agua potable de 15 unidades Hazen -uH-, establecido por la legislación brasilera en la Portaria del Ministerio de la Salud No. 2914, de 2011 [21]. De igual manera, los resultados indicaron que a partir de los 50 min de reacción no se obtuvo mejoría en la remoción de dicho parámetro, cuya eficiencia máxima fue de 68% para color aparente y 70% para color verdadero -valores finales respectivos de 8 y 3 uH-. La Figura 2 ilustra los valores medidos, así como las eficiencias de remoción calculadas.
B. Fase 2, agua del lago de Ipê + NaCl (1 g/L)
Esta fase del experimento fue la única en la que se observaron variaciones en la corriente y voltaje a lo largo del periodo de reacción, con valores entre 5.45 y 5.30 voltios e intensidades de corriente entre 4.45 y 3.60 amperios. Las alteraciones antes comentadas se dieron principalmente por los cambios en la conductividad a lo largo del proceso, pues la electrólisis reduce y oxida los iones Na+ y Cl- provenientes de la dilución de la sal en el agua; dichas reacciones alteran las condiciones de conductividad de la solución alterando así la corriente capaz de atravesar el equipo.
El nivel inicial de color aparente fue de 66 uH y el de color verdadero fue 20 uH; la variación de este parámetro a lo largo del tiempo de reacción, así como la progresión de la eficiencia de su remoción se representan gráficamente en la Figura 3.
Como se puede apreciar en la Figura 3, debido a los mayores valores iniciales de color, únicamente después de 60 minutos de reacción se logró reducir el color aparente hasta 13 uH, para cumplir de esta manera con lo estipulado por la Portaria 2914 [21]. La eficiencia de la remoción fue creciente a lo largo del experimento, con valores máximos de 80.3% para color aparente y 90.0% para color verdadero. La adición de NaCl sugirió un eventual efecto favorable en el desempeño del proceso, puesto que, a diferencia de la primera fase experimental, durante todo el tiempo de la reacción hubo incremento en la eficiencia de remoción del parámetro de interés. La mayor eficiencia de remoción pudo deberse a que la presencia de aluminio liberado en la solución acuosa se incrementa como función de la cantidad de NaCl presente en el líquido, lo que puede contribuir a la presencia de una mayor cantidad de coagulante disponible para remover los contaminantes [22].
C. Fase 3, agua del lago de Ipê + sustancia húmica
Durante esta fase del ensayo y en la que le siguió se mantuvieron constantes los valores del voltaje y del amperaje, de 25 V y 1.1 A. Al agua del lago Ipê se le adicionó sustancia húmica hasta obtener valores iniciales de color aparente y verdadero, de 708 uH y 570 uH, respectivamente. La reacción electrolítica evidenció la remoción progresiva de color con eficiencia final de 87.3% del color aparente y 96.8% del color verdadero, correspondientes a valores finales de 90 uH y 18 uH.
La Figura 4 presenta de manera gráfica los valores de color registrados y las eficiencias de remoción calculadas a lo largo de la fase experimental.
Aunque el valor final del color aparente no se enmarcó dentro de los valores permitidos por la normatividad brasilera, el desempeño del sistema representó una elevada reducción. La eficiencia antes comentada es susceptible de ser complementada por procesos de tratamiento adicionales que también pueden contribuir a la remoción de otros elementos de interés, tales como los virus, hecho que se ha evidenciado al asociar la electrocoagulación a microfiltración por membranas, donde el primer proceso demostró un desempeño superior al de la coagulación química [23]. Dado que la implementación de un sistema bajo las condiciones de la presente fase requeriría de unidades de tratamiento posteriores, podrían considerarse los aspectos relativos a los altos costos del suministro eléctrico del sistema e implementar la reacción hasta el minuto 50, cuya eficiencia fue del 84,6%, para valor final de color aparente de 109 uH.
D. Fase 4, agua del lago de Ipê + sustancia húmica
Al agua del lago se le adicionó sustancia húmica hasta obtener un color aparente inicial de 247 uH y un color verdadero de 150 uH. El proceso electrolítico propició una remoción final del 84.2% del color aparente y del 98.0% del color verdadero, para valores finales de 39 uH y 3 uH. En la Figura 5 se han graficado los valores de color medidos y las eficiencias de remoción calculadas durante la fase experimental.
Pese a que nuevamente el nivel final de color aparente se encontró por encima del valor máximo permitido por la normatividad brasilera, el sistema reportó alta reducción, lo que sugiere la utilidad del proceso como etapa del tratamiento del agua con fines de su potabilización. La mayor eficiencia en la remoción del color verdadero se debió a la adición del dióxido de titanio, compuesto que tiene capacidad de oxidar materiales orgánicos, que se encuentran entre los principales generadores de color verdadero en las aguas naturales.
Nuevamente, en caso de implementar un sistema bajo las condiciones de color de esta fase serían necesarias unidades de tratamiento adicionales, y, al tener en cuenta los costos asociados a las dimensiones del reactor y al suministro eléctrico del sistema, se podría considerar un tiempo de reacción de 50 minutos, en el que se registró una eficiencia de remoción del 81.8% -color aparente final de 45 uH-.
De cualquier manera, el análisis de selección de la(s) tecnología(s) de tratamiento que se han de implementar debe incluir la identificación y análisis de factores asociados a la institucionalización de la tecnología, de aspectos sociales, culturales e institucionales, de los recursos locales y los aspectos tecnológicos, ambientales, económicos y financieros [24].
Entre los aspectos tecnológicos por tener en cuenta, además de la eficiencia de estos sistemas para remover diversos contaminantes, pueden contemplarse algunas ventajas de los procesos electrolíticos, como, por ejemplo: que no necesitan de la adición de productos químicos, no requieren control del pH, se pueden implementar mediante equipos sencillos, son fáciles de operar y generan menores cantidades de lodo, en comparación con la coagulación convencional [25].
En términos generales, la presente investigación demostró la eficiencia del tratamiento electrolítico como etapa del tratamiento del agua para plantas de potabilización del líquido, tanto para aguas con niveles de color no muy elevados (hasta del orden de 60 uH), para las que se logró reducir sus valores por debajo de los niveles máximos establecidos por la legislación brasilera, como para aguas con muy altos niveles de color, pues se logró la remoción eficiente de una elevada fracción de dicho parámetro, cuyo desempeño podrá ser complementado por etapas de tratamiento posteriores. Es recomendable que para la determinación del proceso electrolítico como etapa del tratamiento de agua con fines de potabilización se evalúe su operación en las condiciones más críticas de color y turbidez esperables, por medio de ensayos a escala de laboratorio o pilotos.
IV. Conclusiones
Los resultados demostraron la eficiencia del proceso electrolítico en la remoción de color en aguas con valores moderados; en un tiempo de reacción inferior a una hora se redujeron los valores hasta los niveles de color aparente permitidos, en este caso, por las directrices brasileras para agua potable.
En aguas con muy elevados niveles de color, usualmente correspondientes a picos del parámetro en épocas de lluvias, el proceso electrolítico presenta en tiempos reducidos altas eficiencias de remoción que pueden ser complementadas por etapas de tratamiento posteriores hasta alcanzar los niveles definidos por las normas de potabilización.
La adición de sales puede ser benéfica para el proceso, al reducir el tiempo de exposición del líquido al tratamiento, haciéndolo aún más atractivo como etapa de pretratamiento en plantas de potabilización de agua.
Referencias
[1] M. R. Lima and R. Bresaola. "Uso de reatores de fluxo ascendente como unidades de floculação clarificação na produção de água para abastecimento público," Rev. DAE, vol. 58 (184), pp. 4-10, Sep. 2010. DOI: http://dx.doi.org/10.4322/dae.2014.064.
[2] Programa das Nações Unidas para o Desenvolvimento (PNUD). Resumo Relatório do Desenvolvimento Humano. A água para lá da escassez: poder, pobreza e a crise mundial da água. New York-USA: Programa das Nações Unidas para o Desenvolvimento, 2006.
[3] W. G. Botero, A. dos Santos, L. C. de Oliveira, and J. C. Rocha. "Caracterização de lodo gerado em estações de tratamento de água: perspectivas de aplicação agrícola," Quím. Nova, vol. 32 (8), pp. 2018-2022, Aug. 2009. DOI: http://dx.doi.org/10.1590/S0100-40422009000800007.
[4] L. Di Bernardo, C. C. S. Brandão, and L. Heller. Tratamento de águas de abastecimento por filtração em múltiplas etapas. Rio de Janeiro, Brasil: PROSAB, 1999.
[5] C. Montoya, D. Loaiza, P. Torres, C. H. Cruz, and J. C. Escobar. "Efecto del incremento en la turbiedad del agua cruda sobre la eficiencia de procesos convencionales de potabilización," Rev. EIA, n° 16, pp. 137-148, Dec. 2011.
[6] Companhia Ambiental do Estado de São Paulo- CETESB. Qualidade das águas interiores no estado de São Paulo, Série Relatórios-Apêndice A: significado ambiental e sanitário das variáveis de qualidade das águas e dos sedimentos e metodologias analíticas e de amostragem. São Paulo, Brasil: CETESB, 2009.
[7] A. Barrenechea. "Aspectos fisicoquímicos de la calidad del agua". Tratamiento de agua para consumo humano. Plantas de filtración rápida, Manual I: Teoría, Tomo I. L. Vargas. Lima, Perú: Centro Panamericano de Ingeniería Sanitaria y Ciencias del Ambiente CEPIS/OPS, pp. 1-54, 2004.
[8] World Health Organization (WHO). Guidelines for Drinking-water Quality, Fourth Edition. Geneva, Switzerland: WHO, 2011.
[9] Health Canada, Guidelines for Canadian Drinking Water Quality: Guideline Technical Document-Trihalomethanes. Ottawa, Canada: Water, Air and Climate Change Bureau, Healthy Environments and Consumer Safety Branch-Health Canada, 2006.
[10] Environmental Protection Agency (EPA). Drinking Water Guidance on Disinfection By-Products Advice Note No. 4. Version 2. Disinfection By-Products in Drinking Water. Wexford, Ireland: EPA, Office of Environmental Enforcement, 2012.
[11] M. Rodríguez, G. Rodríguez, J. Serodes, and R. Sadiq. "Subproductos de la desinfección del agua potable: formación, aspectos sanitarios y reglamentación," Rev. Interciencia, vol. 32 (11), pp. 749-756, Nov. 2007.
[12] J. Grimm, D. Bessarabov, and R. Sanderson. "Review of Electro-assisted methods for water purification," Desalination, vol. 115 (3), pp. 285-294, Aug. 1998. DOI: http://dx.10.1016/S0011-9164(98)00047-2.
[13] Metcalf and Eddy. Wastewater engineering, treatment and reuse. Fourth edition-international edition. Singapore: McGraw-Hill, 2004.
[14] W. G. Wiendl. "Processos eletrolíticos para depuração de esgotos: Uma revisão secular," Rev. DAE, vol. 45 (140), pp. 50-54, Mar. 1985.
[15] D. F. de Angelis, C. R. Corso, E. D. Bidoia, P. B. Moraes, R. N. Domingos, and R. C. Rocha-Filho. "Eletrólise de resíduos poluidores: I-efluente de uma indústria liofilizadora de condimentos," Quím. Nova, vol. 21 (1), pp. 20-24, Feb. 1998. DOI: http://dx.doi.org/10.1590/S0100-40421998000100004.
[16] C. Elicker, P. J. Sanches, and K. R. L. Castagno. "Electroremediation of heavy metals in sewage sludge," Braz. J. Chem. Eng., vol. 31 (2), pp. 365-371, Jun. 2014. DOI: http://dx.doi.org/10.1590/0104-6632.20140312s00002394.
[17] E. Butler, Y.-T. Hung, R. Y-L Yeh, and M. S. Al Ahmad. "Electrocoagulation in Wastewater Treatment," Water, vol. 3 (4), pp. 495-525, Apr. 2011. DOI: http://dx.10.3390/w3020495.
[18] L. Di Bernardo and A. Dantas. Métodos e Técnicas de Tratamento de Água. 2ª ed. São Carlos, Brasil: Editora RIMA, 2005.
[19] G. L. Pinheiro, C. A. Silva, and A. E. Furtini. "Crescimento e nutrição de clone de eucalipto em resposta à aplicação de concentrações de c-ácido húmico," Rev. Bras. Ciên. Solo, vol. 34 (4), pp. 1217-1229, Feb. 2010. DOI: http://dx.doi.org/10.1590/S0100-06832010000400021.
[20] L. F. Garcés, E. A. Mejía, and J. J. Santamaría. "La fotocatálisis como alternativa para el tratamiento de aguas residuales," Rev. Lasallista Investig., vol. 1 (1), pp. 83-92, Dec. 2004.
[21] Brasil. Ministério da Saúde. "Portaria No. 2.914, de 12 de dezembro de 2011. Dispõe sobre os procedimentos de controle e de vigilância da qualidade da água para consumo humano e seu padrão de potabilidade". Diário Oficial da União, Brasília, DF: 14 Dec. 2011, n. 239, seção 1, p. 39-46.
[22] G. Mouedhen, M. Feki, M. De Petris, and H.F. Ayedi. "Behavior of aluminum electrodes in electrocoagulation process," J. Hazard. Mater., vol. 150 (1), pp. 124-135, Jan. 2008. DOI: http://dx.10.1016/j.jhazmat.2007.04.090.
[23] B. Zhu, D. A. Clifford, and S. Chellam. "Comparison of electrocoagulation and chemical coagulation pretreatment for enhanced virus removal using microfiltration membranes," Water Res., vol. 39 (13), pp. 3098- 3108, Aug. 2005. DOI: http://dx.10.1016/j.watres.2005.05.020.
[24] L. Di Bernardo and L. P. Sabogal. Seleçãode Tecnologias de Tratamento de Água. São Carlos, Brasil: Editora LDiBe, 2009.
[25] M. Cataldo, L. Barletta, M. Dogliotti, N. Russo, D. Fino, and P. Spinelli. "Heavy metal removal by means of electrocoagulation using aluminum electrodes for drinking water purification," J. Appl. Electrochem., vol. 42 (9), pp. 809-817, Sep. 2012. DOI: http://dx.10.1007/s10800-0120455-8.