



Identificación de parásitos gastrointestinales en mamíferos del Zoológico Guatika (Tibasosa, Colombia)
Identification of gastrointestinal parasites in mammals of the Guatika Zoo (Tibasosa, Colombia)
Identificación de parásitos gastrointestinales en mamíferos del Zoológico Guatika (Tibasosa, Colombia)
Pensamiento y Acción, núm. 26, 2019, pp. 31 -44
Fecha de recepción: 12 Octubre 2018
Fecha de aprobación: 21 Diciembre 2018
Resumen: Las enfermedades en fauna silvestre en cautiverio están asociadas a factores como estrés, condiciones de manejo inadecuadas, calidad del alimento, condición de instalaciones y cantidad de animales, las cuales tienen efectos desfavorables sobre el estado inmunitario y contribuyen a la presencia de enfermedades infecciosas, entre ellas las producidas por parásitos que producen alteraciones graves y en algunos casos la muerte de los animales. El objetivo del presente estudio fue determinar la prevalencia y carga de parásitos gastrointestinales en mamíferos del Zoológico Guatika (Tibasosa, Colombia); para esto se realizó un estudio transversal con muestreo poblacional a 23 especies de mamíferos, en los que se colectaron muestras de materia fecal que fueron procesadas y analizadas utilizando las técnicas de Ritchie modificada y flotación de Sheather modificada, para determinar la prevalencia y carga parasitaria. La prevalencia general obtenida fue de 95,7 %, siendo los coccidios los más prevalentes con 48 %, seguido de Taenia sp. 9,7 %, Baylisascaris procyonis 6,5 %, Dictyocaulus viviparus 3,2 %, Capillaria sp. 3,2 %, Toxocara felis 3,2 % y Strongyloides sp. 3.2 %. Así mismo se obtuvieron valores de ooquistes por gramo de materia fecal (OPG) mínimos de 150 (Panthera leo, Dasyprocta fuliginosa y Cerdocyon thous) y máximos de 4600 (Cuniculus taczanowskii) y valores de huevos por gramo de materia fecal (HPG) mínimos de 50 (Eira barbara, Lagotrix lagotrichia, Nasua nasua, Pecari tajacu y Hidrochoerus hidrochaeris) y máximos de 300 (Ursus arctos horribilis y Odocoelius virginianus).
Palabras clave: animal salvaje, mamífero, parásito.
Abstract: Diseases in wildlife captivity are associated with factors such as stress, inadequate management conditions, food quality, condition of facilities and number of animals, which have unfavorable effects on the immune status, contributing to the presence of infectious diseases, among them those produced by parasites that produce serious alterations and in some cases the death of animals. The aim of the present study was to determine the prevalence and burden of gastrointestinal parasites in mammals of the Guatika Zoo (Tibasosa, Colombia). For this, a cross-sectional study was carried out with population sampling of 23 mammalian species, in which fecal samples were collected and processed and analyzed using the Modified Ritchie and Modified Sheather Flotation techniques to determine the prevalence and parasitic burden. The general prevalence obtained was 95.7%, with the most prevalent parasites coccidia with 48%, followed by Taenia sp. 9.7%, Baylisascaris procyonis 6.5%, Dictyocaulus viviparus 3.2%, Capillaria sp. 3.2%, Toxocara felis 3.2% and Strongyloides sp. 3.2%. Likewise, values of oocysts per gram of fecal matter (OPG) of 150 (Panthera leo, Dasyprocta fuliginosa and Cerdocyon thous) and maximum values of 4600 (Cuniculus taczanowskii) and egg values per gram of fecal matter (HPG) were obtained. 50 (Eira barbara, Lagotrix lagotrichia, Nasua nasua, Pecari tajacu and Hydrochoerus hydrochaeris) and maximum of 300 (Ursus arctos horribilis and Odocoelius virginianus).
Keywords: mammals, parasites, wild animals.
Introducción
La explotación indiscriminada de los recursos naturales en Colombia ha facilitado el deterioro de los ecosistemas, provocando en su mayoría el aumento de la vulnerabilidad de especies silvestres de fauna y flora, lo que lleva a una mayor probabilidad de extinción (Ministerio de Ambiente y Desarrollo Sostenible, 2012). La situación de estas especies en vida libre se ve afectada por la disminución del hábitat por causas antrópicas, falta de presas, tráfico de pieles y caza furtiva; debido a esto, ha surgido la necesidad de crear lugares que permitan a las especies de fauna silvestre ser mantenidas bajo ciertas condiciones donde se promueva la realización de programas que van desde la reproducción hasta el repoblamiento en su hábitat natural (Acosta, Tantaleán & Serrano-Martínez, 2015).
A pesar de los esfuerzos realizados, los animales que ingresan a estos centros sufren, además de la privación de la libertad y la modificación en la dieta, algunas patologías que conducen finalmente a estrés, traducido en alteraciones de tipo metabólico, variaciones en el comportamiento y deficiencias en su sistema inmunológico, los cuales facilitan la adquisición de agentes patógenos como parásitos (Emikpe, Morenikeji & Jarikre, 2016).
La presencia de parasitosis en condiciones de cautiverio se encuentra asociada a una diversidad de factores que predisponen a una infección. Se ha considerado el hecho de que al no estar los animales en su ambiente natural sufren distintas manifestaciones generadas por estrés, las cuales tienen efectos desfavorables sobre su estado inmunitario. Este hecho, sumado a condiciones de manejo inadecuadas en cuanto a calidad del alimento, condición de las instalaciones, número de animales y actividades profilácticas, contribuye a que los individuos se tornen más susceptibles a varias enfermedades infecciosas, entre ellas las producidas por parásitos, las cuales en vida libre no representan mayor riesgo, pero en cautiverio pueden producir lesiones graves y, en algunos casos, la muerte de los animales (Oyola, Zapata, Torres, Ríos & Zapata, 2010; Atanaskova, Kochevski, Stefanovska & Nikolovski, 2011). El parasitismo en todas sus manifestaciones representa una preocupación clínica importante por el fuerte impacto que tiene sobre las condiciones de salud en las diferentes poblaciones de animales; la presencia de los endoparásitos en el sistema digestivo en los animales silvestres es una de las causas de enfermedad más importante, debido a que producen alta morbilidad y mortalidad (Mukul-Yerves, Zapata-Escobedo, Montes-Pérez, Rodríguez-Vivas & Torres-Acosta, 2014)
Para un control integral de las condiciones parasitarias es necesario comprender los ciclos biológicos de los parásitos. Existen factores propios del huésped, del parásito y del medio ambiente, que influyen en el mismo. En el caso del huésped, se considera la edad, la alimentación y el modo de vida; mientras que en lo relacionado con el parásito, se resalta la presencia de formas de resistencia en el medio externo, como quistes y larvas encapsuladas; y los factores más importantes asociados con el medio ambiente incluyen el clima, la estación del año, la altura y el tipo de suelo (Aranda, Serrano-Martínez, Tantaleán, Quispe & Casas, 2013). Otro de los factores es la relación que existe entre la fauna parasitaria y el modo de vida del hospedador, puesto que cuando se presenta una alta densidad poblacional en un espacio inadecuado o reducido, aumenta la cantidad de materia fecal por metro cuadrado, hecho que multiplica la cantidad de larvas por área; este factor, sumado a la presencia de una población susceptible, incrementa las probabilidades de infección (Santos, Silva, Fonseca & Oliveira, 2015).
De los pocos estudios realizados nacional e internacionalmente en zoológicos y centros de rehabilitación de fauna silvestre, se revela la presencia de huevos y larvas de helmintos como nematodos, cestodos, trematodos y acantocéfalos, especialmente de los géneros Capillaria spp, Ascaridia spp y diferentes ooquistes de coccidios en animales silvestres en cautiverio, que no solo acarrean problemas a los animales que los poseen, sino que aumentan el riesgo de posibles zoonosis, especialmente a aquellas personas encargadas del cuidado y manejo de estas especies (Oyola et al., 2010; Mukul-Yerves et al., 2014; Santos et al., 2015).
En la actualidad, los zoológicos se preocupan por la bioseguridad, sin embargo, nunca se está exento de problemas de parásitos que pueden o bien proceder de la alimentación o de medios externos como vectores vivos o inertes (Chavarro-Tulcán & Rojas-Rodríguez, 2014). Por lo anterior, el objetivo del presente estudio es determinar la prevalencia y carga de parásitos gastrointestinales en mamíferos del Zoológico Guatika (Tibasosa, Colombia).
Metodología
El estudio fue realizado en los mamíferos del Zoológico Guatika, localizado en el municipio de Tibasosa, departamento de Boyacá (Colombia). El Parque Zoológico Guatika está ubicado en las coordenadas 5°44'23.3"N 73°00'23.5"W, con una temperatura media de 16 ºC y una altitud de 2538 msnm, sobre el cerro Guatika del municipio de Tibasosa; es el primer parque temático del departamento con una extensión de 29 hectáreas (Alcaldía de Tibasosa, 2018). Las muestras de materia fecal fueron trasladadas al Laboratorio de Parasitología Veterinaria de la Universidad Pedagógica y Tecnológica de Colombia para el respectivo procesamiento y análisis.
Se hizo un estudio transversal con muestreo poblacional a 23 especies de mamíferos correspondientes a: Ursus arctos horribilis, Panthera tigris, Puma concolor, Eira barbara, Callicebus ornatus, Lagotrix lagotrichia, Potos flavus, Cuniculus taczanowskii, Nasua nasua, Dasyprocta fuliginosa, Panthera onca, Cerdocyon thous, Leopardus pardalis, Urocyon cinereoargenteus, Lontra longicaudis, Galictis vittata, Odocoelius virginianus, Panthera leo, Pecari tajacu, Tapirus terrestres, Hidrochoerus hidrochaeris, Sapajus apella, Cebus albifrons.
Las muestras se tomaron solo una vez directamente del suelo de cada recinto, específicamente de la zona de manejo en animales que viven solos y de las zonas de mantenimiento de los animales que conviven en grupos. Antes de la llegada de los animales al área de manejo y recolección de las muestras se hizo limpieza de estas zonas para evitar la contaminación del material biológico. Se recolectó la materia fecal más fresca en horas de la mañana, tomando aproximadamente 30 g de cada muestra, descartando la parte superior, base y borde; el interior del bolo fecal quedó como muestra para el procesamiento. Las muestras se almacenaron en un único recipiente, en el caso de los animales que viven solos, y en el caso de los que conviven en grupos, fue un surtido de distintas deposiciones tomadas al azar en los recintos.
La materia fecal se almacenó en guantes mediante técnica de inversión y con la debida identificación. Posteriormente se transportó en neveras de refrigeración con hielo seco evitando el contacto directo con la muestra, previniendo su congelación y factores externos que la alteraran. Después, las muestras fueron procesadas y analizadas utilizando las técnicas de Ritchie modificada y Flotación de Sheather modificada con el fin de identificar huevos, larvas u ooquistes. La identificación de los géneros y las especies de parásitos se llevó a cabo por la morfología (forma, cubierta, color y contenido) de los huevos y de las larvas, de acuerdo con Arrojo (2002) y Vieira, Luque y Muniz-Pereira (2008).
Los resultados fueron tabulados en una hoja de Excel, para posteriormente ser analizados por el programa estadístico IBM SPSS Statistics versión 19; luego se aplicó la técnica estadística de chi-cuadrado (x2) para determinar si hubo o no diferencia estadística entre las frecuencias de individuos infectados y observar la prevalencia de cada uno de los parásitos teniendo en cuenta la fórmula: Prevalencia = (N.º animales positivos/Población total) x 100 y establecer la carga parasitaria mediante la fórmula huevos/ooquistes = Número de huevos u ooquistes *50, con el fin de establecer el número de huevos por gramo de materia fecal (HPG) u ooquistes por gramo de materia fecal (OPG) (Altman & Bland, 2001).
Resultados
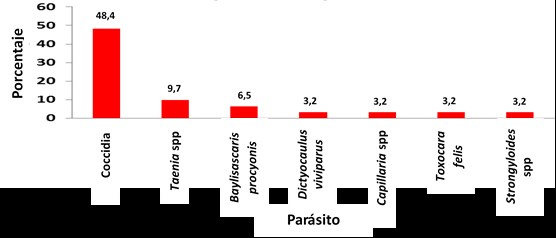
La prevalencia general obtenida (Figura 1) fue de 95,7 %. Se determinó la prevalencia de cada parásito a partir de la cantidad de individuos positivos, siendo el grupo parasitario de los coccidios el más prevalente, con 48 %; seguido de Taenia sp. 9,7 %; Baylisascaris procyonis, 6,5 %; Dictyocaulus viviparus, 3,2 %; Capillaria sp, 3,2 %; Toxocara felis, 3,2 % y Strongyloides sp. con 3,2 %.
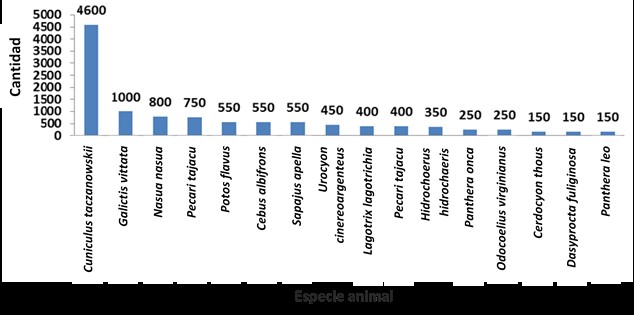
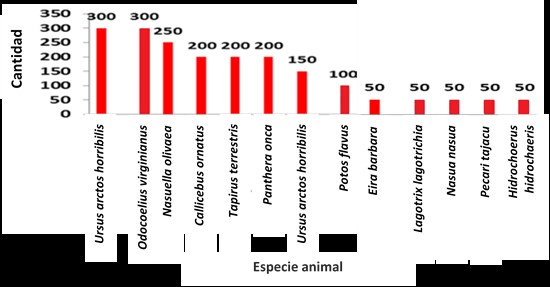
Así mismo se hizo el conteo de ooquistes y huevos por gramo de materia fecal (OPG y HPG) (figuras 2 y 3), para determinar la carga parasitaria presentada en cada una de las especies animales analizadas, obteniendo valores de OPG mínimos de 150 (Panthera leo, Dasyprocta fuliginosa y Cerdocyon thous) y máximos de 4600 (Cuniculus taczanowskii) y valores de HPG mínimos de 50 (Eira barbara, Lagotrix lagotrichia, Nasua nasua, Pecari tajacu y Hidrochoerus hidrochaeris) y máximos de 300 (Ursus arctos horribilis y Odocoelius virginianus).
Discusión y conclusiones
La prevalencia de parásitos gastrointestinales encontrada fue de 95,7 %; cifra similar al 95 % hallado por Figueiroa, Bianque, Dowell, Alves y Evencio (2001), pero superior en comparación con el 61 % y 62 % encontrados en zoológicos de Brasil y Perú (Müller, Greinert & Silva, 2005; Aranda et al., 2013). Esta diferencia podría deberse a las condiciones de manejo ambiental y sanitario, donde se observa que factores como fuentes de agua de bebida, fuente de alimento, presencia de huéspedes transportadores y condiciones sanitarias adecuadas en encierros y áreas de manejo juegan un papel fundamental en la presencia o ausencia de agentes patógenos (Guerrero, Serrano, Tantaleán, Quispe & Casas, 2012). Por otro lado, la frecuencia de parasitismo hallada es mayor que la observada en estudios realizados a animales en vida libre, donde se asume que existen las condiciones adecuadas para la transmisión parasitaria, como mayores fuentes de infección, presencia de hospederos intermediarios y ausencia de manejo farmacológico (Bevins et al., 2012; García-Prieto, Falcón-Ordaz & Guzmán-Cornejo, 2012).
Las infecciones parasitarias gastrointestinales suelen cursar de manera asintomática, afectando en su mayoría a animales jóvenes, y la carga parasitaria se ve reflejada en cambios físicos y comportamentales como retardo en el crecimiento y disminución del consumo de alimento (Suzán, Galindo & Ceballos, 2000). Las aves y los roedores juegan un papel importante como fuente de infección en zoológicos, ya que estos pueden tener acceso a los encierros y zonas de descanso de los animales; de igual forma, los manejadores o cuidadores se convierten en fuente potencial de transporte de agentes patógenos por medio del calzado o utensilios utilizados para su trabajo diario. Además, las modificaciones realizadas en el medio ambiente de los animales favorecen la diseminación de enfermedades, en especial aquellas transmitidas por vectores (Lafferty, 2012).
Al estar en cautiverio, diversos grupos de mamíferos son vulnerables a la presentación de endoparásitos en diferentes estadios, observándose casos de Capillaria sp en grandes roedores (Santa Cruz et al., 2004), Ancylostoma tubaeforme, Toxocara cati, Toxascaris leonina y Cystoisospora felis en felinos (Martínez, Binda, Laffont & Rodríguez, 2010) y Trichuris sp., Capillaria sp., Moniezia sp. y Eimeria sp en caribú del Atlántico (Turgeon, Kutz, Lejeune, St-Laurent & Pelletier, 2018). Situación similar ocurre en el Zoológico Guatika, donde los parásitos identificados fueron: coccidios, Taenia sp. Baylisascaris procyonis, Dictyocaulus viviparus, Capillaria sp. Toxocara felis y Strongyloides sp, destacándose la presencia de Taenia sp, Capillaria sp y Toxocara felis como agentes causales de zoonosis, lo que implica el riesgo de transmisión al personal encargado del manejo de los animales (Carver et al., 2012).
A pesar de lo anterior, el concepto de enfermedad se dificulta en animales silvestres; mientras que la presentación de un agente patógeno en el ser humano y en animales domésticos es interpretada como anormal, todos los vertebrados silvestres albergan gran cantidad de patógenos que pueden comportarse como parásitos o comensales (García-Corredor, Sánchez-Parada, Pulido-Medellín & Andrade-Becerra, 2013); es por esto que al estudiar enfermedades, dolencias y otras alteraciones en animales silvestres mantenidos en cautiverio, es necesario tener en cuenta la tríada ecológica que establece el equilibrio entre el animal hospedero, el agente etiológico y el ambiente, ya que cualquier alteración en este equilibrio puede generar el proceso patológico, siendo la parasitosis una de las más comunes en mamíferos silvestres (Mino-Botello, Romero-Callejas, Ramírez-Bravo & Aguilar-Ubeda, 2016).
El parasitismo en todas sus manifestaciones representa una preocupación clínica significativa por el fuerte impacto que tiene sobre las condiciones de salud en las diferentes poblaciones de animales. La presencia de los endoparásitos en el sistema digestivo en los mamíferos silvestres es una de las enfermedades infecciosas más importantes, debido a que produce alta morbilidad y mortalidad; sin embargo, la especificidad en el caso de animales silvestres no es clara, ya que se ha revelado variedad de aparición de parásitos en las diferentes familias de mamíferos (Lafferty, 2012).
Agradecimientos
A las directivas, profesionales de medicina veterinaria y biología, personal de manejo y administrativo del Zoológico Guatika, por la colaboración y el apoyo brindados en la ejecución de este trabajo.
Referencias
Acosta Z. M., Tantaleán V. M., & Serrano-Martínez, E. (2015). Identificación de parásitos gastrointestinales por coproscopía en carnívoros silvestres del Zoológico Parque de las Leyendas, Lima, Perú. Revista de Investigaciones Veterinarias del Perú, 26(2), 282-290. DOI: https://doi.org/10.15381/rivep.v26i2.11000.
Alcaldía Municipal de Tibasosa. (2018). Municipio. Recuperado de http://www.tibasosa-boyaca.gov.co/tema/municipio
Altman, D. G., & Bland, J.M. (2001). Statistics Notes: Diagnostic Tests 1: Sensitivity and Specificity. British Medical Journal, 308(6943), 1552-1553. DOI: https://doi.org/10.1136/bmj.308.6943.1552.
Aranda, C., Serrano-Martínez, E., Tantaleán, M., Quispe, M., & Casas, G. (2013). Identificación y frecuencia de parásitos gastrointestinales en félidos silvestres en cautiverio en el Perú. Revista de Investigaciones Veterinarias del Perú, 24(3), 360-368. DOI: https://doi.org/10.15381/rivep.v24i3.2585.
Arrojo, L. (2002). Parásitos de animales silvestres en cautiverio en Lima, Perú. Revista Peruana de Biología, 9(2), 118-120.
Atanaskova, E., Kochevski, Z., Stefanovska, J., & Nikolovski, G. (2011). Endoparasites in Wild Animals at the Zoological Garden in Skopje, Macedonia. Journal of Threatened Taxa, 3(7), 1955–1958. DOI: https://doi.org/10.11609/JoTT.o2440.1955-8.
Bevins, S. N., Carver, S., Boydston, E. E., Lyren, L. M., Alldredge, M., Logan, K. A., & Salman, M. (2012). Three Pathogens in Sympatric Populations of Pumas, Bobcats, and Domestic Cats: Implications for Infectious Disease Transmission. PLoS One, 7(2), e31403. DOI: http://doi.org/10.1371/journal.pone.0031403.
Camargo-Cepeda, D., & Ávila, E. (2014). Efectos del Trichoderma sp. sobre el crecimiento y desarrollo de la arveja (Pisum sativum L.). Ciencia y Agricultura, 11(1), 91-100. DOI: https://doi.org/10.19053/01228420.3492.
Carver, S., Scorza A. V., Bevins, S. N., Riley, S. P., Crooks, K. R., Van de Woude, S., & Lappin, M.R. (2012). Zoonotic Parasites of Bobcats around Human Landscapes. Journal of Clinical Microbiology, 50(9), 3080-3083. DOI: https://doi.org/10.1128/JCM.01558-12.
Chavarro-Tulcán, G. I., & Rojas-Rodríguez, A. P. (2014). Estudio piloto comportamental de Panthera onca. Ciencia y Agricultura, 11(2), 17-23. DOI: https://doi.org/10.19053/01228420.3833.
Díaz-Monroy, B., Iglesias, A., & Valiño-Cabrera, E. (2014). Consorcios microbianos con actividad ácido-láctica promisoria aislados desde inoculantes bacterianos nativos para ensilajes. Ciencia y Agricultura, 11(1), 17-25. DOI: https://doi.org/10.19053/01228420.3484.
Emikpe, B. O., Morenikeji, O. A., & Jarikre, T. A. (2016). Zoo Animals’ Disease Pattern in a University Zoological Garden, Ibadan, Nigeria. Asian Pacific Journal of Tropical Disease, 6(2), 85-89. DOI: https://doi.org/10.1016/S2222-1808(15)60991-4.
Figueiroa, M., Bianque, J., Dowell, M., Alves, R., & Evencio, A. (2001). Perfil coproparasitológico de mamíferos silvestres en cautiverio en el estado de Pernambuco, Brasil. Parasitología al Día, 25(3-4), 121-125. DOI: http://doi.org/10.4067/S0716-07202001000300009.
García-Corredor, D., Sánchez-Parada, O., Pulido-Medellín, M., & Andrade-Becerra, R. (2013). Identificación de parásitos gastrointestinales en aves silvestres en cautiverio. Revista Científica, 23(3), 254-258.
García-Prieto, L., Falcón-Ordaz J., & Guzmán-Cornejo, C. (2012). Helminth Parasites of Wild Mexican Mammals: List of Species, Host and Geographical Distribution. Zootaxa, 3290, 1-92.
Guerrero, F., Serrano, E., Tantaleán, M., Quispe, M., & Casas, G. (2012). Identificación de parásitos gastrointestinales en primates no humanos del Zoológico Parque Natural de Pucallpa, Perú. Revista de Investigaciones Veterinarias del Perú, 23(4), 469-478. DOI: https://doi.org/10.15381/rivep.v23i4.962.
Lafferty, K. D. (2012). Biodiversity Loss Decreases Parasite Diversity: Theory and Patterns. Philosophical Transactions of the Royal Society, 367(1604), 2814-2827. DOI: https://doi.org/10.1098/rstb.2012.0110.
Martínez, F. A., Binda, J. L, Laffont, G., & Rodríguez, M. (2010): Parasitosis más frecuentes en felinos silvestres. Veterinaria Argentina, 27, 262-268.
Ministerio de Ambiente y Desarrollo Sostenible. (2012). Estrategia nacional para la prevención y control al tráfico ilegal de especies silvestres: diagnóstico y plan de acción ajustado. Bogotá, Colombia: Ministerio de Ambiente y Desarrollo Sostenible.
Mino-Botello, D. D., Romero-Callejas, E., Ramírez-Bravo, O. E., & Aguilar-Ubeda, A. (2016). Determinación de parásitos gastrointestinales en carnívoros en el centro de México. Acta Zoológica Mexicana, 32(2), 210-212. DOI: https://doi.org/10.21829/azm.2016.322953.
Mukul-Yerves, J. M., Zapata-Escobedo, M., Montes-Pérez, R. C., Rodríguez-Vivas, R. I., & Torres-Acosta, J. F. (2014). Parásitos gastrointestinales y ectoparásitos de ungulados silvestres en condiciones de vida libre y cautiverio en el trópico mexicano. Revista Mexicana de Ciencias Pecuarias, 5(4), 459-469. DOI: https://doi.org/10.22319/rmcp.v5i4.4017.
Müller, G. C. K., Greinert, J. A., & Silva Filho, H. H. (2005). Freqüência de parasitas intestinais em felinos mantidos em zoológicos. Arquivo Brasileiro de Medicina Veterinária e Zootecnia, 57(4), 559-561. DOI: https://doi.org/10.1590/S0102-09352005000400021
Oyola, N., Zapata, R., Torres, G. A., Ríos, L. A., & Zapata, M.A. (2010). Frecuencia de parásitos intestinales en fauna exótica y silvestre del Zoológico Santafé en Medellín, Colombia. CES Medicina, 24(2), 108-109.
Páez-Barón, E., & Corredor-Camargo, E. (2014). Evaluación de la aptitud reproductiva del toro. Ciencia y Agricultura, 11(2), 49-59. DOI: https://doi.org/10.19053/01228420.3837.
Santa Cruz, A. C., González, A. O., Sarmiento, N. F., Comolli, J. A., González, J. A., Cayo, D. O., Obregón, G., & Roux, J. P. (2004). Observación de huevos de Capillaria sp. (Nematoda: Capillariidae) en carpincho (Hydrochaeris Hydrochaeris, Linnaeus, 1766). Comunicaciones científicas y tecnológicas. Corrientes, Argentina: Universidad Nacional del Nordeste.
Santos, P. M. S., Silva, S. G. N., Fonseca, C. F., & Oliveira J. B. (2015). Parasites of Birds and Mammals in Captivity in Pernambuco State, Brazil. Parasitos de aves e mamíferos em cativeiro no estado de Pernambuco. Pesquisa Veterinária Brasileira 35(9), 788-794. DOI: https://doi.org/10.1590/S0100-736X2015000900004.
Suzán, G., Galindo, F., & Ceballos, G. (2000). La importancia del estudio de enfermedades en la conservación de fauna silvestre. Veterinaria México, 31(3), 223-228.
Turgeon, G., Kutz, S. J., Lejeune, M., St-Laurent, M. H., & Pelletier, F. (2018). Parasite Prevalence, Infection Intensity and Richness in an Endangered Population, the Atlantic-Gaspésie Caribou. International Journal for Parasitology: Parasites and Wildlife, 7(1), 90-94. DOI: https://doi.org/10.1016/j.ijppaw.2018.02.001.
Vieira, F. M., Luque, J., & Muniz-Pereira, L. (2008). Checklist of Helminths Parasites in Wild Carnivore Mammals from Brazil. Zootaxa, 1721, 1-23.
Notas de autor
1 Universidad Pedagógica y Tecnológica de Colombia (Tunja-Boyacá, Colombia). melissa.ortiz@uptc.edu.co. ORCID: https://orcid.org/0000-0002-9761-7335.
2 M. Sc. Universidad Pedagógica y Tecnológica de Colombia (Tunja-Boyacá, Colombia). martin.pulido@uptc.edu.co. ORCID: http://orcid.org/0000-0003-4989-1476.
3 M. Sc. Universidad Pedagógica y Tecnológica de Colombia (Tunja-Boyacá, Colombia). diegojose.garcia@uptc.edu.co. ORCID: http://orcid.org/0000-0001-5122-5435.
Información adicional
Para citar este artículo: Ortiz-Pineda,
M. C., Pulido-Medellín, M. O., & García-Corredor, D. J. (2019). Identificación
de parásitos gastrointestinales en mamíferos del Zoológico Guatika
(Tibasosa, Colombia). Pensamiento y Acción, 26,
31-44.