



Anaplasmosis y babesiosis: estudio actual
Anaplasmosis and babesiosis: current study
Anaplasmosis y babesiosis: estudio actual
Pensamiento y Acción, núm. 26, 2019, pp. 45 -60
Fecha de recepción: 12 Abril 2019
Fecha de aprobación: 21 Junio 2019
Resumen: La salud animal cobra importancia cuando en los procesos productivos se generan impactos en costos y en el riesgo de infecciones zoonóticas, lo cual, sin embargo, puede mitigarse con varias estrategias. Una es el estudio de mejores métodos diagnósticos para la vigilancia y el control de enfermedades, que está emergiendo como una prioridad en enfermedades como la anaplasmosis y la babesiosis. En el transcurso de los últimos años se han observado pérdidas económicas que rondan los billones de pesos anuales y que en países de baja producción impactan de manera negativa en los pequeños productores. El diagnóstico temprano y la investigación de potenciales biomarcadores mediante la aplicación de herramientas moleculares son estrategias que deben integrarse en el estudio actual de estas enfermedades, de manera que las decisiones frente a la emergencia de perfiles epidemiológicos favorezcan la oportuna intervención y el control de la enfermedad de transmisión vectorial. El propósito de esta revisión es conocer los avances en el estudio de la babesiosis y la anaplasmosis relacionados con su impacto y con la exploración de marcadores moleculares.
Palabras clave: Anaplasma, Babesia, impacto, genes.
Abstract: Animal health becomes important when in production processes impacts on costs and risk of zoonotic infections are generated, which, however, can be mitigated with various strategies. One is the study of better diagnostic methods for surveillance and control of diseases, which is emerging as a priority in diseases such as anaplasmosis and babesiosis. Over the last few years economic losses around trillions of pesos per year have been observed, and in countries of low production have a negative impact on small producers. Early diagnosis and investigation of potential biomarkers through the application of molecular tools are strategies that need to be integrated in the current study of these diseases, so that decisions in the face of the emergence of epidemiological profiles favor the timely intervention and control of vector-borne disease. The purpose of this review is to know the advances in the study of babesiosis and anaplasmosis related to their impact and progress in exploration of molecular markers.
Keywords: Anaplasma, Babesia, impact, genes.
Introducción
Las garrapatas duras (Acari: Familia Ixodidae) son ectoparásitos obligados hematófagos, que necesitan sangre durante una parte fundamental de su ciclo de vida. Se consideran uno de los factores sanitarios más importantes que impactan de manera negativa la ganadería en el trópico y que afectan al 80 % de la población bovina del mundo, son agentes disruptores en sistemas productivos. La especie de garrapatas Rhipicephalus microplus (R. microplus), denominada la “garrapata común del ganado”, es la especie que más repercute económicamente en Centroamérica, Suramérica, África y Asia, con mayor incidencia en el corredor biológico del Caribe, principalmente en Colombia y Venezuela (Polanco & Ríos, 2016; Cortés-Vecino, 2018; Vecino et al., 2010; Jongejan & Uilenberg, 2004).
Por los hábitos hematófagos, este ectoparásito se identifica como el vector de enfermedades en animales, específicamente transmite babesiosis (Babesia bigemina y Babesia bovis) y anaplasmosis (Anaplasma marginale); además se le atribuye la pérdida de peso por la presencia de entre 20 a 30 garrapatas por animal, daños en la piel por acción de las picaduras, pérdida de sangre, debilitamiento, estrés, disminución en la producción de leche y menor eficiencia reproductiva del hato (Sepúlveda, Pulido-Medellín & Enrique, 2017).
Su presencia en explotaciones ganaderas es fuente de pérdidas económicas que en el contexto mundial se registran entre 2000 a 3000 millones de dólares. R. microplus es uno de los principales obstáculos en la producción ganadera en regiones tropicales y subtropicales. Se estima que es la responsable de pérdidas económicas anuales de aproximadamente 2,5 billones de dólares en el mundo, y de 76 713 millones de pesos por año en Colombia (Sepúlveda et al., 2017). Las pérdidas están relacionadas con su capacidad vectorial, permanencia del ectoparasitismo, picadura indolora y por ser un reservorio de patógenos como los géneros Babesia y Anaplasma (Echeverry & Osorio, 2016). El género Babesia produce una enfermedad parasitaria febril transmitida por garrapatas y causada por uno o más parásitos protozoarios de dicho género, el cual se caracteriza porque ocasiona una lisis eritrocítica extensiva que conduce a anemia y muerte. Fue reportada por primera vez en 1888 por Viktor Babes en Rumania (Muñoz, 2017). Anaplasma marginale (A. marginale) es una rickettsia que parasita los eritrocitos maduros del ganado bovino y provoca una marcada anemia hemolítica, disminución del peso, altos niveles de rickettsemia, aborto y, en algunos casos, muerte en animales de más de tres años de edad (González et al., 2014). Los animales que sobreviven a la infección aguda permanecen como portadores con continuos ciclos submicroscópicos de rickettsemia que pueden persistir durante toda la vida del animal (Martínez, Álvarez & Viloria, 2016).
Se estima que más de 1,2 billones de bovinos alrededor del mundo están expuestos a estos patógenos, siendo los géneros de transmisión vectorial los de mayor importancia en el ganado vacuno del mundo. América Latina es un área de riesgo permanente para el desarrollo de garrapatas y la trasmisión de enfermedades, con más de 264 millones de bovinos amenazados en países del Mercosur (Vasco, 2013). Como estrategia de mitigación se tiene el control químico, que actualmente está amenazado por el desarrollo de resistencias a los acaricidas. De acuerdo con la Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO), la resistencia de R. microplus a organofosforados, carbamatos, lactonas macrocíclicas, piretroides sintéticos y amitraz está ampliamente distribuida en el ámbito global (Vasco, 2013).
En Colombia, todas las zonas ganaderas localizadas en áreas de trópico bajo y trópico medio se consideran regiones enzoóticas para los hemoparásitos del ganado (González et al., 2014). En el curso de la enfermedad, los animales se convierten en reservorios, por lo que es necesario poder contar con técnicas de diagnóstico más sensibles y específicas para ser utilizadas en el movimiento internacional de ganado hacia zonas libres de la enfermedad, que permitan la detección de animales portadores, así como para conocer la prevalencia de la enfermedad en las regiones tropicales y subtropicales (Jaimes-Duéñez, Triana-Chávez & Mejía-Jaramillo, 2017). Estas enfermedades son de interés desde hace décadas, pues en las Américas se dan las condiciones bioecológicas para la presencia de los vectores. Vale mencionar la vigencia de los estudios que muestran su impacto en Colombia y en otros países (Costa et al., 2016; Rodríguez et al., 2014).
La presente revisión tiene el objetivo de conocer y agrupar los avances diagnósticos en técnicas moleculares, mediante la implementación de nuevos epítopes antigénicos para la oportuna y rápida identificación de los hemoparásitos correspondientes a anaplasmosis y babesiosis bovina.
Metodología
Se hizo una búsqueda bibliográfica en bases de datos Pub-med E-Libro, Ovid, Scopus, Proquest, Science Direct, Dialnet, con descriptores como Anaplasma, Babesia, impacto, diagnóstico. genes, con un intervalo no mayor a diez años, en inglés y español. Las publicaciones consultadas se seleccionaron por subtema de interés, se referenciaron artículos de fechas anteriores por la importancia del dato aportado.
Resultados
La anaplasmosis es causada por el género Anaplasma que pertenece a la familia Anaplasmataceae del orden Rickettsiales. Se encuentran principalmente las especies Anaplasma centrale y A. marginale. Esta última es la causa de los grandes brotes y coincide con el genogrupo ll de las Ehrlichiae (Duque & Prada, 2017).
Anaplasma marginale es reportada por primera vez en 1894 como inclusiones en células eritrocitarias de becerras; y posteriormente, en África del Sur en 1910 se hace la descripción completa por Arnol Theiler, quien reporta la existencia de dos tipos, marginal (A. marginale) y central (A. centrale). Para 1926, Darlington reconoce picos de fiebre en Texas (Estados Unidos), asociados con babesiosis y anaplasmosis, siendo así los primeros reportes en el Nuevo Mundo (Duque & Prada, 2017).
Como ya se anotó, la anaplasmosis es una enfermedad que presenta marcada anemia hemolítica, altos niveles de rickettsemia, disminución del peso, aborto y, en muchos casos, la muerte en animales de más de tres años de edad. La anemia máxima ocurre de uno a seis días después de la parasitemia y persiste de cuatro a 15 días; hasta el 75 % de los eritrocitos se pierde de la circulación. El período de convalecencia es de uno a dos meses, está acompañado por incremento de la hematopoyesis y puede haber recurrencia de la parasitemia. Los semovientes que sobreviven a la infección aguda son infectantes durante el resto de su vida (Martínez et al., 2016).
La babesiosis bovina es una enfermedad parasitaria febril, transmitida por garrapatas y causada por uno o más parásitos protozoarios del género Babesia, que generalmente se caracteriza porque ocasiona una lisis eritrocítica extensiva que conduce a anemia y muerte; situación que acarrea pérdidas económicas significativas para los ganaderos. Las manifestaciones clínicas de la enfermedad incluyen fiebre, anorexia, depresión, debilidad, ataxia, hemoglobinuria, anemia, ictericia, aumento de la frecuencia cardíaca y respiratoria, membranas mucosas pálidas o ictéricas y la presencia de parásitos intraeritrocíticos. La importancia económica de la babesiosis aumenta debido a los abortos, la reducción de la producción de leche o carne e incluso la mortalidad (Muñoz, 2017; Hashem, Neamat-Allah & Gheith, 2018).
La babesiosis fue reportada por primera vez en 1888 por Viktor Babes en Rumania, quien identificó al parásito tras analizar muestras sanguíneas de bovinos con signos de anemia hemolítica y hemoglobinuria. En 1893, Theobald Smith y Frederick Kilborne demostraron que la garrapata Rhipicephalus annulatus era la responsable de trasmitir la enfermedad en los bovinos (Muñoz, 2017).
Presentación clínica de la babesiosis
En la babesiosis se observan diferentes tipos de acciones patógenas, tales como acción mecánica (lisis de glóbulos rojos), acción tóxica (liberación y excreción de productos tóxicos, tras el metabolismo de los zoítos, demostrada en el SNC) y acción expoliadora, en cuanto compite por determinadas sustancias del organismo hospedador (Vasco, 2013). Estas acciones patogénicas son referidas por el daño de las diferentes formas que adopta el parásito en su ciclo de vida.
La enfermedad aguda se caracteriza por la hemólisis, el edema, la anemia y la trombosis. Se forman inmunocomplejos que al depositarse sobre la membrana basal de los epitelios dan lugar a los procesos vasculares y digestivos característicos de la enfermedad. La enfermedad aguda, por lo general, dura una semana; el primer síntoma es la fiebre de 41 ºC o más. La fiebre puede estar entre 41-42 °C y durar de dos a siete días o más, persiste a lo largo de la enfermedad y se acompaña de inapetencia, aumento de la frecuencia respiratoria y temblores musculares (Vasco, 2013; Muñoz, 2017).
Cuando se infecta un animal, la multiplicación de la Babesia en los vasos periféricos o en los viscerales alcanza un máximo con el desarrollo de hemólisis clínicamente identificable después de un período de incubación de siete a 20 días. Esta hemólisis produce anemia intensa, ictericia y hemoglobinuria, y la muerte sobreviene probablemente por anoxia anémica. La afectación del sistema nervioso central (SNC) debido a la adhesión de eritrocitos parasitados en los capilares del cerebro puede ocurrir por la infección con Babesia bovis (Muñoz, 2017).
Las infecciones por Babesia bovis se caracterizan por fiebre alta, ataxia, anorexia, shock circulatorio general y, a veces, también signos nerviosos como resultado del secuestro de eritrocitos infectados en capilares cerebrales, además de que también activan macrófagos para liberar histamina y 5-hydroxytryptamina, causando vasodilatación, hipotensión, aumento de la permeabilidad capilar, edema y colapso vascular. Evidencia de laboratorio sugiere que Babesia spp. induce una leucocitosis para liberar radicales libres de oxígeno, los cuales son tóxicos y contribuyen al daño endotelial y al aumento de los efectos de estasis circulatorio e hipotensión (Vasco, 2013; Muñoz, 2017).
Presentación clínica de la anaplasmosis
Esta enfermedad puede ser transmitida por artrópodos hematófagos, tales como algunos géneros de garrapatas, principalmente Rhipicephalus microplus, La forma iatrogénica juega un papel muy importante en la diseminación de la enfermedad a través de material quirúrgico contaminado. Otro tipo de transmisión que se menciona es la transmisión transplacentaria, la cual es descrita en algunos estudios experimentales. Esto ocurre principalmente entre el segundo y tercer tercio de la gestación (Córdoba, 2016).
El período de incubación varía ocho semanas y depende del número inicial de organismos que infectan. Durante este tiempo, el animal permanece asintomático. Los primeros signos clínicos se hacen evidentes durante la etapa de desarrollo, cuando más del 15 % de los eritrocitos están infectados. La duración de este período comprende entre los cuatro a nueve días. Tras la detección de la infección eritrocítica, el número de eritrocitos parasitados aumenta geométricamente. Los eritrocitos infectados son posteriormente fagocitados por las células reticuloendoteliales bovinas, lo que resulta en desarrollo de anemia leve a severa e ictericia sin hemoglobinemia o hemoglobinuria (Córdoba, 2016; Kocan et al., 2010).
El organismo, que es una bacteria intracelular obligada, penetra por invaginación al eritrocito sin que ocurra destrucción de las células, se encierra en una vacuola y se multiplica por fisión binaria en forma de cuerpo de inclusión, observándose de dos a tres cuerpos. Los signos clínicos pueden incluir fiebre, pérdida de peso, aborto, letargo, ictericia y, a menudo, la muerte en animales mayores de dos años. La anemia máxima ocurre de uno a seis días después de la parasitemia y persiste por cuatro a 15 días, donde hasta el 75 % de los eritrocitos se pierden de la circulación. Los parámetros hemáticos retornan a los normales, pero los organismos continúan presentes en la circulación periférica. Los animales que sobreviven a la infección aguda permanecen como portadores con continuos ciclos submicroscópicos de rickettsemia, que pueden persistir durante toda la vida del animal (Córdoba, 2016; Kocan et al., 2010).
Estudios diagnóstico marcadores moleculares
En la revisión realizada se observó que desde hace dos décadas la investigación de estas enfermedades se ha centrado en la búsqueda de marcadores moleculares utilizados para la identificación de géneros y especies específicas para Babesia y Anaplasma. (Tabla 1).
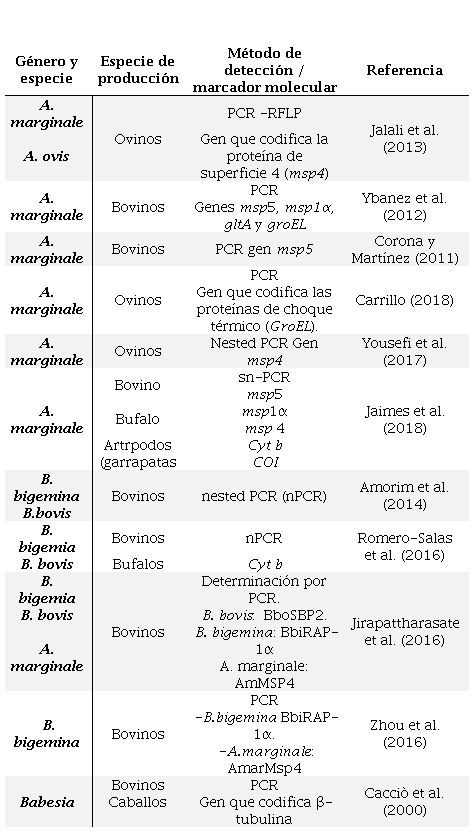
Epidemiología e impacto
Las enfermedades transmitidas por vectores a lo largo de la historia han llegado a ser consideradas un problema de salud pública, sobre todo en los climas tropicales y subtropicales, como en el que se encuentra Colombia, pero a causa del cambio climático tan agresivo que se ha dado durante las últimas décadas, y de los tratados de libre comercio, las enfermedades transmitidas por vectores se estén expandiendo a lugares en los cuales no se encontraban. La compleja epidemiología de las enfermedades transmitidas por vectores crea desafíos significativos en el diseño y la implementación de estrategias de prevención y control, especialmente ante los rápidos cambios sociales y ambientales. Muchas enfermedades están especialmente limitadas, por ejemplo, las enfermedades transmitidas por vectores y zoonóticas ocurren donde y cuando los vectores, los hospedadores animales, los patógenos y las poblaciones humanas susceptibles se superponen. R. microplus está considerada como una de las especies de garrapatas con mayor distribución en regiones tropicales y subtropicales del mundo, que afecta aproximadamente al 80 % de la población bovina y se encuentra desde el nivel del mar hasta los 2903 msnm y a temperaturas que oscilan entre 15 y 34 °C, con una humedad relativa entre 85 y 90 % (Sepúlveda et al., 2017; Savíc et al., 2014; Cálderon, Martínez & Iguarán, 2016).
La anaplasmosis bovina es endémica en Sudáfrica, aunque se considera que Cabo del Norte está libre de la enfermedad. En ese país, el papel desempeñado por las especies de garrapatas en la transmisión de la anaplasmosis ha sido poco estudiado, y durante mucho tiempo se ha asumido que la garrapata de un solo huésped, Rhipicephalus decoloratus, es el principal vector de la enfermedad. Esto se debe a la coexistencia de esta garrapata y la enfermedad en áreas endémicas del país (Hove et al., 2017). La anaplasmosis es una de las enfermedades económicamente más importantes del ganado bovino en Sudáfrica, ocasiona pérdidas significativas de productividad y, en algunos casos, mortalidad. Allí, al igual que en todo el mundo, los efectos de las enfermedades transmitidas por garrapatas en los animales a menudo son sinérgicos, pues los animales se infectan con más de un patógeno a la vez. Por lo tanto, los estudios para cuantificar las pérdidas que son específicamente atribuibles a la anaplasmosis bovina todavía no se han llevado a cabo en dicha nación. En otras partes del mundo, los costos derivados de la anaplasmosis bovina se han estimado entre 300 y 800 millones de dólares. Además, los costos económicos atribuibles a la carga y al control de la enfermedad para la babesiosis y la anaplasmosis en conjunto se han aproximado a 2,5 billones de dólares alrededor del mundo, 875 millones de dólares en Sudamérica y 30.5 millones en Australia, mientras que en Colombia las pérdidas ascienden a 76 713 millones de pesos por año (Sepúlveda et al., 2017; Hove et al., 2017). Colombia, debido a su ubicación tropical, brinda unas condiciones óptimas para la proliferación de artrópodos, especialmente garrapatas, las cuales son vectores importante de hemoparásitos como Babesia bigemina,Babesia bovis y la rickettsia Anaplasma marginale.
En el mundo, la ganadería es una actividad que contribuye directamente a la subsistencia y la seguridad alimentaria de cerca de mil millones de personas, y afecta la dieta y la salud de muchos más. Se ha estimado la población promedio mundial en 1,43 billones de bovinos. En Colombia, el panorama no es muy distinto, pues la ganadería es una actividad de mucha importancia desde el punto de vista económico y social en el sector rural, ya que ocupa la mayor parte del área agropecuaria del país. Según el ICA, la población bovina en el país en 2017 es de 23,5 millones de cabezas, distribuidas en 514 794 predios, principalmente en los departamentos de Antioquia (11,67 %), Córdoba (8,61 %), Casanare (8,18 %), Meta (7,36 %), Santander (6,26 %) Cesar (6,02 %), Caquetá (5,94 %), Cundinamarca (5,57 %) y Magdalena (5,35 %), departamentos que agrupan el 64,96 % de la población total nacional. De acuerdo con el censo nacional del ICA del año 2017, Boyacá tiene 837 567 bovinos, siendo el departamento que ocupa el décimo lugar en producción doble propósito en el país (Martínez, 2016; ICA, 2017; Benavides et al., 2012).
Según el último reporte anual entregado por el Instituto Colombiano Agropecuario (ICA, 2015), hubo 9528 predios afectados en el país, de los cuales el 10,59 % corresponde a enfermedades causadas por hemoparásitos (ICA, 2018).
Se estima que en Colombia hay alrededor de 81 735 bovinos en riesgo de contraer anaplasmosis, de los cuales se enfermarían cerca de 1.8 bovinos por cada 100, y morirían 5.9 bovinos por cada mil; aunque para babesiosis el panorama no es diferente, ya que se estima que la población bovina en riesgo de contraer la enfermedad es de 54 963, con una incidencia de 1.7 bovinos por cada 100, pero los índices de mortalidad son más elevados en cuanto a anaplasmosis, porque cuenta con una tasa de mortandad de 8.7 bovinos por cada mil.
Conclusiones
En la actualidad, la anaplasmosis y la babesiosis han aumentado los índices de morbimortalidad, ocasionando cuantiosas pérdidas a los productores y convirtiéndose en un problema de sanidad animal. La integración de los nuevos métodos de diagnóstico para estos hemoparásitos es la alternativa para un análisis rápido, efectivo y especifico, lo que sugiere la inserción de la tecnología molecular a la vigilancia y el control en la producción bovina.
Una de las mayores dificultades en el diagnóstico de anaplasmosis y babesiosis se da porque como no son catalogadas como enfermedades de notificación inmediata por sanidad animal, la gran mayoría de los casos de morbimortalidad presentados pasan desapercibidos, lo cual dificulta establecer la estadística exacta.
Los actuales criterios de diagnóstico molecular se han convertido en un pilar de determinación precoz de dichas enfermedades, ya que mediante la amplificación de genes específicos expresados por los epítopes antigénicos de los parásitos se logra establecer su presencia de manera más eficaz y oportuna.
Referencias
Amorim, L. S., Wenceslau, A., Carvalho, F., Carneiro, P., Souza, L., & Albuquerque, G. R. (2014). Bovine babesiosis and anaplasmosis complex: diagnosis and evaluation of the risk factors from Bahia, Brazil. Revista Brasileira de Parasitologia Veterinária. 23(3), 328-336. https://doi.org/10.1590/s1984-29612014064.
Benavides, E., Vizcaíno, O., Polanco, N., Mestra, A. & Betancur, O. J. (2012). Efecto terapéutico de un fármaco frente a los hemoparásitos del bovino Babesia bovis, Babesia bigemina y Anaplasma marginale. Bogotá: Programa de Medicina Veterinaria, Facultad de Ciencias Agropecuarias, Universidad de La Salle.
Cacciò, S., Cammà, C., Onuma, M., & Severini, C. (2000). The β-tubulin gene of Babesia and Theileria parasites is an informative marker for species discrimination. International Journal for Parasitology, 30(11), 1181-1185. https://doi.org/10.1016/s0020-7519(00)00105-3.
Calderón, A., Martínez, N., & Iguarán, H. (2016). Frecuencia de hematozoarios en bovinos de una región del caribe colombiano. Revista UDCA Actualidad & Divulgación Científica, 19(1), 131-138. https://doi.org/10.31910/rudca.v19.n1.2016.118.
Carrillo, A. C. (2018). Detección microbiológica y molecular de Anaplasma spp. en ganado bovino del municipio de Ovejas, Sucre, Colombia. Sincelejo: Universidad de Sucre.
Córdoba, M. A. (2016). Anaplasmosis bovina: abordaje clínico y patológico de la enfermedad. (Tesis doctoral). Corporación Universitaria Lasallista, Caldas, Antioquia.
Corona, B. & Martínez, S. (2011, abr.). Detección de Anaplasma marginale en bovinos, mediante la amplificación por PCR del gen msp5. Rev Salud Anim., 33(1), 24-31.
Cortés-Vecino, J. A. (2018). Control integrado de garrapatas y su importancia en salud pública. Biomédica, 38(4), 452-455.
Costa, S. C. et al. (2016). Transplacental transmission of bovine tick-borne pathogens: frequency, co-infections and fatal neonatal anaplasmosis in a region of enzootic stability in the northeast of Brazil. Ticks and Tick-Borne Diseases, 7(2), 270-275. https://doi.org/10.1016/j.ttbdis.2015.11.001.
Duque, S., & Prada, J. A. (2017). Anaplasmosis bovina, historia, actualidad, clínica e impacto económico en la ganadería. Caldas, Antioquia: Corporación Universitaria Lasallista.
Echeverry, D. P., & Osorio, L. A. R. (2016). Aspectos biológicos y ecológicos de las garrapatas duras. Ciencia y Tecnología Agropecuaria, 17(1), 81-95. https://doi.org/10.21930/rcta.vol17_num1_art:463.
González, B. C., Obregón, D., Alemán, Y., Alfonso, P., Vega, E., Díaz, A., & Martínez, S. (2014). Tendencias en el diagnóstico de la anaplasmosis bovina. Revista de Salud Animal, 36(2), 73-79.
Hashem, M., Neamat-Allah, A. N., & Gheith, M. A. (2018, October). A study on bovine babesiosis and treatment with reference to hematobiochemical and molecular diagnosis. Veterinary Medicine In-between Health & Economy (VMHE), 55(20-Suppl), 16-19.
Hove, P., Khumalo, Z., Chaisi, M., Oosthuizen, M., Brayton, K., & Collins, N. (2018). Detection and Characterisation of Anaplasma marginale and A. centrale in South Africa. Veterinary Sciences, 5(1), 26. https://doi.org/10.3390/vetsci5010026.
Instituto Colombiano Agropecuario ICA. (s.f.). Censo Pecuario Nacional 2017. Disponible en https://www.ica.gov.co/Areas/Pecuaria/Servicios/Epidemiologia-Veterinaria/Censos-2016/Censo-2017.aspx
Instituto Colombiano Agropecuario-Sanidad Animal. (2018). Boletín Epidemiológico 2015. Bogotá: ICA.
Jaimes-Duéñez, J., Triana-Chávez, O., & Mejía-Jaramillo, A.M. (2017). Parasitological and molecular surveys reveal high rates of infection with vector-borne pathogens and clinical anemia signs associated with infection in cattle from two important livestock areas in Colombia. Ticks and Tick-Borne Diseases, 8(2), 290-299. https://doi.org/10.1016/j.ttbdis.2016.12.002.
Jaimes-Dueñez, J., Triana-Chávez, O., & Mejía-Jaramillo, A. M. (2018). Genetic, host and environmental factors associated with a high prevalence of Anaplasma marginale. Ticks and Tick-Borne Diseases, 9(5), 1286-1295. https://doi.org/10.1016/j.ttbdis.2018.05.009.
Jalali, S. M., Khaki, Z., Kazemi, B., Bandehpour, M., Rahbari, S., Razi Jalali, M., & Yasini, S. P. (2013). Molecular detection and identification of Anaplasma species in sheep from Ahvaz, Iran. Iranian Journal of Veterinary Research, 14(1), 50-56.
Jirapattharasate, C., Adjou Moumouni, P. F., Cao, S., Iguchi, A., Liu, M., Wang, G., & Xuan, X. (2016). Molecular detection and genetic diversity of bovine Babesia spp., Theileria orientalis, and Anaplasma marginale in beef cattle in Thailand. Parasitology Research, 116(2), 751–762. https://doi.org/10.1007/s00436-016-5345-2.
Jongejan, F. & Uilenberg, G. (2004). The global importance of ticks. Parasitology, 129(S1), S3-S14. https://doi.org/10.1017/s0031182004005967.
Kocan, K. M., De la Fuente, J., Blouin, E. F., Coetzee, J. F. & Ewing, S. A. (2010). The natural history of Anaplasma marginale. Veterinary Parasitology, 167(2-4), 95-107. https://doi.org/10.1016/j.vetpar.2009.09.012.
Mejía, J. A. B., Cueto, M. E. D., Suárez, A., & Álvarez, J. A. C. (2017). Distribución geográfica de la casuística clínica bovina del servicio ambulatorio de grandes animales de la Universidad de Córdoba (Colombia). Revista de Medicina Veterinaria, (34), 101-114. https://doi.org/10.19052/mv.4259.
Martínez, R., Álvarez, J. C., & Viloria, M. V. (2016). Prevalencia de parásitos hematrópico endoglobulares en bovinos gyr puros en Córdoba, Colombia. Revista de Medicina Veterinaria, (31), 67-74. https://doi.org/10.19052/mv.3710.
Martínez, R., Blanco, J., Cardona, A., & Vargas, M. (2017). Prevalencia de parásitos hematrópicos endoglobulares en bovinos gyr puros en Córdoba, Colombia. Revista de Medicina Veterinaria, (31), 67-74. https://doi.org/10.19052/mv.3710.
Muñoz, T. (2017). Babesiosis bovina (Babesia bovis y Babesia bigemina), una enfermedad hematozoárica de importancia económica en el mundo. Centro de Biotecnología, 5(1).
Polanco, D., & Ríos, L. (2016). Aspectos biológicos y ecológicos de las garrapatas duras. Ciencia y Tecnología Agropecuaria, 17(1), 81-95. https://doi.org/10.21930/rcta.vol17_num1_art:463.
Rodríguez-Vivas, R. I., Rosado-Aguilar, J. A., Ojeda-Chi, M. M., Pérez-Cogollo, L. C., Trinidad-Martínez, I., & Bolio-González, M. E. (2014). Control integrado de garrapatas en la ganadería bovina. Ecosistemas y Recursos Agropecuarios, 1(3), 295-308.
Romero-Salas, D., Mira, A., Mosqueda, J., García-Vázquez, Z., Hidalgo-Ruiz, M., Vela, N. A. O., & Schnittger, L. (2016). Molecular and serological detection of Babesia bovis-and Babesia bigemina-infection in bovines and water buffaloes raised jointly in an endemic field. Veterinary Parasitology, 217, 101-107. https://doi.org/10.1016/j.vetpar.2015.12.030.
Savić, S., Vidić, B., Grgić, Z., Potkonjak, A., & Spasojevic, L. (2014). Emerging vector-borne diseases–incidence through vectors. Frontiers in Public Health, 2, 267. https://doi.org/10.3389/fpubh.2014.00267.
Sepúlveda, A. L., Pulido-Medellín, M. O., & Enrique, J. (2017). Eficiencia in vitro de hongos entomopatógenos y productos químicos sobre Rhipicephalus microplus. Tunja, Boyacá: Programa de Medicina Veterinaria y Zootecnia, Universidad Pedagógica y Tecnológica de Colombia.
Vasco, A. (2013). Estandarización de la técnica de análisis de fusión de alta resolución para la detección de Babesia en garrapatas utilizando polimorfismos de nucleótidos. Quito: Universidad Central del Ecuador.
Vecino, J. A., Echeverri, J. A., Cárdenas, J. A., & Herrera, L. A. (2010). Distribución de garrapatas Rhipicephalus (Boophilus) microplus en bovinos y fincas del Altiplano cundiboyacense (Colombia). Ciencia y Tecnología Agropecuaria, 11(1), 73-84. https://doi.org/10.21930/rcta.vol11_num1_art:197.
Ybanez, A. P., Sivakumar, T., Ybanez, R. H. D., Ratilla, J. C., Perez, Z. O., Gabotero, S. R., & Inokuma, H. (2013). First molecular characterization of Anaplasma marginale in cattle and Rhipicephalus (Boophilus) microplus ticks in Cebu, Philippines. Journal of Veterinary Medical Science, 75(1), 27-36. https://doi.org/10.1292/jvms.12-0268.
Yousefi, A., Rahbari, S., Shayan, P., Sadeghi-dehk26ordi, Z., & Bahonar, A. (2017). Molecular detection of Anaplasma marginale and Anaplasma ovis in sheep and goat in west highland pasture of Iran. Asian Pacific Journal of Tropical Biomedicine, 7(5), 455–459. https://doi.org/10.1016/j.apjtb.2017.01.017.
Zhou, M., Cao, S., Sevinc, F., Sevinc, M., Ceylan, O., Moumouni, P. F. A., & Xuan, X. (2016). Molecular detection and genetic identification of Babesia bigemina, Theileria annulata, Theileria orientalis and Anaplasma marginale in Turkey. Ticks and Tick-Borne Diseases, 7(1), 126-134. https://doi.org/10.1016/j.ttbdis.2015.09.008.
Notas de autor
1 Universidad de Boyacá (Tunja-Boyacá, Colombia). dhvargas@uniboyaca.edu.co.
2 M. Sc. Universidad de Boyacá (Tunja-Boyacá, Colombia). mariaitorres@uniboyaca.edu.co. ORCID: https://orcid.org/0000-0003-0690-3182.
3 M. Sc. Universidad Pedagógica y Tecnológica de Colombia (Tunja-Boyacá, Colombia). martin.pulido@uptc.edu.co ORCID: https://orcid.org/0000-0003-4989-1476.
Información adicional
Para citar este artículo: Vargas-Cuy,
D. H., Torres-Caycedo, M. I., & Pulido-Medellín,
M. O. (2019). Anaplasmosis y babesiosis:
estudio actual. Pensamiento y Acción,
26, 45-60.