Consorcios microbianos espontáneos e inducidos: la clave para fermentaciones de cacao de alta calidad
Resumen
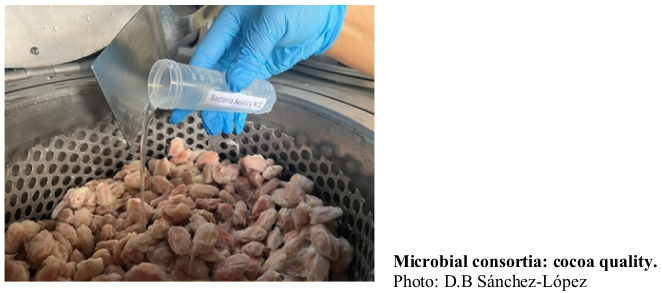
>La fermentación del cacao permite la acción de microorganismos que son cruciales para su aroma y sabor. Este estudio evaluó cómo mejorar la calidad poscosecha del cacao utilizando consorcios microbianos específicos y un dispositivo de fermentación controlada en seis momentos diferentes: 0, 24, 48, 72, 96 y 120 horas. Se compararon tres tratamientos utilizando granos de cacao CCN51: fermentación espontánea (FESP), inoculación con Saccharomyces cerevisiae-CAO-004, Issatchenkia orientalis-CAO-003 y Gluconacetobacter sp.-CAO-008 (SIGO), y con Saccharomyces cerevisiae-CAO-004, Lactobacillus plantarum-CAO-009 y Acetobacter pasteurianus-CAO-010 (SILA). Se analizaron pH, dinámica microbiana, ácidos orgánicos, alcaloides, polifenoles, capacidad antioxidante y perfil sensorial. Los tratamientos que involucraron la inducción de consorcios microbianos no solo aumentaron la cantidad de levaduras, bacterias del ácido láctico y ácido acético, sino que también modificaron los niveles de ácidos orgánicos presentes y superaron en calidad, clasificando el cacao como premium y mostrando diferencias significativas en alcaloides como cafeína y flavonoides como las catequinas. El SIGO obtuvo la mayor puntuación (8) por su equilibrio de sabores y notas frutales, dulces y de nuez. El SILA, con una puntuación de 7,5, también se destacó por el equilibrio de sabores y atributos frutales, de nuez y florales. La inoculación de consorcios microbianos específicos y el uso de un dispositivo de fermentación controlada mejoran la calidad y el sabor del cacao CCN51, ofreciendo una herramienta para optimizar la fermentación y mejorar el producto final y a su vez, mejorando la calidad y competitividad del cacao y fomentado la innovación y sostenibilidad en la industria, optimizando el proceso y asegurando un producto final de alto valor añadido.
Palabras clave
Calidad del cacao, Material genético, Fermentación, Teobroma cacao
Archivo(s) complementario(s)
PDF Suppl 2 (English)Citas
- Acevedo-Osorio, Á., J.S. Santoyo-Sánchez, P. Guzmán, and N. Jiménez-Reinales. 2018. Family farming facing the extractive model of rural development in Colombia. Gest. Ambient. 21(Suppl. 2), 144. Doi: https://doi.org/10.15446/ga.v21n2supl.73925
- Acierno, V. 2020. Following cocoa beans to chocolate: The search for intrinsic characteristics. PhD thesis, University Wageningen, Wageningen, The Netherlands.
- Afoakwa, E.O., J. Quao, J. Takrama, A.S. Budu, and F.K. Saalia. 2013. Chemical composition and physical quality characteristics of Ghanaian cocoa beans as affected by pulp pre-conditioning and fermentation. J. Food Sci. Technol. 50(6), 1097-1105. Doi: https://doi.org/10.1007/s13197-011-0446-5
- Aria, P.S. (ed.). 2023. AOAC official method 970.21. pH of cacao products: potentiometric method. In: Latimer, G.W. (ed.). Official methods of analysis of AOAC international. 22th ed. New York, NY. Doi: https://doi.org/10.1093/9780197610145.003.2884
- Barišić, V., N.C. Icyer, S. Akyil, O.S. Toker, I. Flanjak, and Đ. Ačkar. 2023. Cocoa based beverages–Composition, nutritional value, processing, quality problems and new perspectives. Trends Food Sci. Technol. 132, 65-75. Doi: https://doi.org/10.1016/j.tifs.2022.12.011
- Benzie, I.F.F. and J.J. Strain. 1996. The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power”: the FRAP assay. Anal. Biochem. 239(1), 70-76. Doi: http://dx.doi.org/10.1006/abio.1996.0292
- Bhat, R., B. Bhavishya, and S. Sujatha. 2024. Cocoa (Theobroma cacao L.). In: Thomas, G.V. and V. Krishnakumar (eds.). Soil health management for plantation crops. Springer, Singapore. Doi: https://doi.org/10.1007/978-981-97-0092-9_8
- Camu, N., T. De Winter, K. Verbrugghe, I. Cleenwerck, P. Vandamme, J.S. Takrama, M. Vancanneyt, and L. De Vuyst. 2007. Dynamics and biodiversity of populations of lactic acid bacteria and acetic acid bacteria involved in spontaneous heap fermentation of cocoa beans in Ghana. Appl. Environ. Microbiol. 73, 1809-1824. Doi: https://doi.org/10.1128/AEM.02189-06
- Castillejos-Mijangos, L.A., O.G. Meza-Márquez, G. Osorio-Revilla, C. Jiménez-Martínez, and T. Gallardo-Velázquez. 2023. Identification of variety and prediction of chemical composition in cocoa beans (Theobroma cacao L.) by FT-MIR spectroscopy and chemometrics. Foods 12(22), 4144. Doi: https://doi.org/10.3390/foods12224144
- Cevallos-Cevallos, J.M., L. Gysel, M.G. Maridueña-Zavala, and M.J. Molina-Miranda. 2018. Time‐related changes in volatile compounds during fermentation of bulk and fine‐flavor cocoa (Theobroma cacao) beans. J. Food Qual. 2018(1), 1758381. Doi: https://doi.org/10.1155/2018/1758381
- Clark, D.H. (ed.). 2023. AOAC official method 942.15 acidity (titratable) of fruit products. C37-11. In: Latimer, G.W. (ed.). Official methods of analysis of AOAC International. 22th ed. New York, NY. Doi: https://doi.org/10.1093/9780197610145.003.3390
- De Vuyst, L. and F. Leroy. 2020. Functional role of yeasts, lactic acid bacteria and acetic acid bacteria in cocoa fermentation processes. FEMS Microbiol. Rev. 44(4), 432-453. Doi: https://doi.org/10.1093/femsre/fuaa014
- De Vuyst, L. and S. Weckx. 2016. The cocoa bean fermentation process: from ecosystem analysis to starter culture development. J. Appl. Microbiol. 121(1), 5-17. Doi: https://doi.org/10.1111/jam.13045
- Falconí, C.E., V. Yánez-Mendizábal, R.J. Haro, and D.R. Claudio. 2023. Inoculum of a native microbial starter cocktail to optimize fine-aroma cocoa (Theobroma cacao) bean fermentation. Agronomy 13(10), 2572. Doi: https://doi.org/10.3390/agronomy13102572
- Ganeswari, I., K.S. Bariah, M.A. Amizi, and K.Y. Sim. 2015. Effects of different fermentation approaches on the microbiological and physicochemical changes during cocoa bean fermentation. Int. Food Res. J. 22(1), 70-76.
- Hirko, B., H. Mitiku, and A. Getu. 2023. Role of fermentation and microbes in cacao fermentation and their impact on cacao quality. Syst. Microbiol. Biomanufacturing 3(4), 509-520. Doi: https://doi.org/10.1007/s43393-023-00160-9
- ICONTEC, Instituto Colombiano de Normas Técnicas y Certificación. 2004. NTC 5278. Análisis Sensorial. Metodología. Análisis secuencial. Bogota.
- ICONTEC, Instituto Colombiano de Normas Técnicas y Certificación. 2009. NTC 3929. Análisis sensorial. Metodología. Métodos del perfil del sabor. Bogota.
- ICONTEC, Instituto Colombiano de Normas Técnicas y Certificación. 2012. NTC 3501. Análisis Sensorial. Vocabulario. Bogota.
- ICONTEC, Instituto Colombiano de Normas Técnicas y Certificación. 2017. GTC 280. Análisis sensorial. Directrices para la selección, entrenamiento y seguimiento de evaluadores sensoriales seleccionados y expertos. Bogota.
- ICONTEC, Instituto Colombiano de Normas Técnicas y Certificación. 2020. GTC 232. Análisis sensorial. Metodología. Guía general para el establecimiento de un perfil sensorial. Bogota.
- ICONTEC, Instituto Colombiano de Normas Técnicas y Certificación. 2021 NTC 1252. Cacao en grano. especificaciones y requisitos de calidad. Bogota.
- Kadow, D., N. Niemenak, S. Rohn, and R. Lieberei. 2015. Fermentation-like incubation of cocoa seeds (Theobroma cacao L.) Reconstruction and guidance of the fermentation process. LWT Food Sci Technol. 62(1), 357-361. Doi: https://doi.org/10.1016/j.lwt.2015.01.015
- Lagos-Quispe, T.M., E.E. Vásquez-Montenegro, G. Rojas-Yauri, I.L. Huamani-Urpe, and J.C. Sosa-Choque. 2024. Fermentación de cacao criollo y CCN-51: bacteria Lactobacillus fermentum y levadura Saccharomyces cerevisiae. Rev. Univ. Soc. 16(4), 52-63.
- Li, Y., Y. Feng, S. Zhu, C. Luo, J. Ma, and F. Zhong. 2012. The effect of alkalization on the bioactive and flavor related components in commercial cocoa powder. J. Food Compost. Anal. 25(1), 17-23. Doi: https://doi.org/10.1016/j.jfca.2011.04.010
- MinAgricultura, Ministerio de Agricultura y Desarrollo Rural. 2023. Agronet: Cifras agropecuarias. Agricola Cacao https://www.agronet.gov.co/estadistica/Paginas/home.aspx?cod=1; consulted: April, 2025.
- Mota-Gutierrez, J., C. Botta, I. Ferrocino, M. Giordano, M. Bertolino, P. Dolci, M. Cannoni, and L. Cocolin. 2018. Dynamics and biodiversity of bacterial and yeast communities during fermentation of cocoa beans. Appl. Environ. Microbiol. 84(19), e01164-18. Doi: https://doi.org/10.1128/AEM.01164-18
- Navajas-Porras, B., S. Pérez-Burillo, J. Morales-Pérez, J.A. Rufián-Henares, and S. Pastoriza. 2020. Relationship of quality parameters, antioxidant capacity and total phenolic content of EVOO with ripening state and olive variety. Food Chem. 325, 126926. Doi: https://doi.org/10.1016/j.foodchem.2020.126926
- Nielsen, D.S., O.D. Teniola, L. Ban-Koffi, M. Owusu, T.S. Andersson, and W.H. Holzapfel. 2007. The microbiology of Ghanaian cocoa fermentations analysed using culture-dependent and culture-independent methods. Int. J. Food Microbiol. 114(2), 168-186. Doi: https://doi.org/10.1016/j.ijfoodmicro.2006.09.010
- Ordoñez, E.S., Y. Quispe, and L.F. García. 2020. Quantification of phenols, anthocyanins and sensory characterization of nibs and liquor of five cocoa varieties, in two fermentation systems. Sci. Agropecu. 11(4), 473-481. Doi: https://doi.org/10.17268/sci.agropecu.2020.04.02
- Pallares, A.P., M. Estupiñán, J.A.P. Villamil, and L.J.L. Giraldo. 2016. Impacto de la fermentación y secado sobre el contenido de polifenoles y capacidad antioxidante del clon de cacao CCN-51. Rev. Ion. 29, 7-21. Doi: https://doi.org/10.18273/revion.v29n2-2016001
- Quintana, L. and A. García. 2021. Evaluación integral de la calidad sensorial del cacao. UNAD, Bogota. Doi: https://doi.org/10.22490/9789586517782
- Ramírez, L., E. Chávez, D. Bravo, B. Moyano, and V. Sánchez. 2024. Plataforma multiagencia de cacao. ATN/RF-17235-RG. In: https://www.fontagro.org/new/uploads/productos/17235_-_Producto_12.pdf; consulted: April, 2025.
- Re, R., N. Pellegrini, A. Proteggente, A. Pannala, M. Yang, and C. Rice-Evans. 1999. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radic. Biol. Med. 26(9-10), 1231-1237. Doi: https://doi.org/10.1016/S0891-5849(98)00315-3
- Sánchez-López, D.B., L.G. Rodriguez-Silva, M.R. Espinosa-Carvajal, and R.A. Coronado-Silva. 2023. Microbiological, sensory and bromatological characterization of cocoa fermentation in ICS 95 and CCN 51 genotypes FAVE. Secc. Cienc. Agrar. 22, e0016. Doi: https://doi.org/10.14409/fa.2023.22.e0016
- Toapanta, M.G.C., G.K.M. Pilay, G.T.S. Paula, and H.A.M. Cano. 2023. Métodos de fermentación en el cacao CCN-51 con norma INEN 176 en la parroquia Guasaganda. Polo del Conocimiento: Rev. Científ. Prof. 8: 613-633. Doi: https://doi.org/10.23857/pc.v8i6
- Van de Voorde, D., C. Díaz-Muñoz, C.E. Hernandez, S. Weckx, and L. De Vuyst. 2023. Yeast strains do have an impact on the production of cured cocoa beans, as assessed with Costa Rican Trinitario cocoa fermentation processes and chocolates thereof. Front. Microbiol. 14, 1232323. Doi: https://doi.org/10.3389/fmicb.2023.1232323
- Viesser, J.A., G.V.M. Pereira, D.P. Carvalho Neto, H. Rogez, A. Góes-Neto, V. Azevedo, B. Brenig, F. Aburjaile, and C.R. Soccol. 2021. Co-culturing fructophilic lactic acid bacteria and yeast enhanced sugar metabolism and aroma formation during cocoa beans fermentation. Int. J. Food Microbiol. 339, 109015. Doi: https://doi.org/10.1016/j.ijfoodmicro.2020.109015
- Wills, C. 2008. Regulation of sugar and ethanol metabolism in Saccharomyces cerevisiae. Crit. Rev. Biochem. Mol. Biol. 25(4), 245-280. Doi: https://doi.org/10.3109/10409239009090611
- Zhang, W., P. Weng, and Z. Wu. 2019. Fermentation efficiency and flavor characteristics of bayberry wine with mixed starter culture of Issatchenkio orientalis and Saccharomyces cerevisiae, Shipin Kexue. Food Sci. 40(18), 144-151. Doi: https://doi.org/10.7506/spkx1002-6630-20180831-375
