Actividad antifúngica In Vitro de extractos etanólicos de Cnidoscolus urens L. en el control de Colletotrichum spp. en Lycopersicum esculentum: una perspectiva agrícola sostenible
Resumen
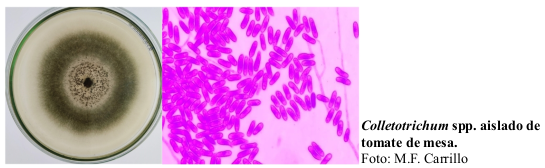
La antracnosis, causada por el hongo patógeno Colletotrichum spp., representa una amenaza importante para el cultivo del tomate de mesa (Lycopersicum esculentum). Este estudio profundiza en el potencial de los extractos vegetales de Cnidoscolus urens L. como estrategia alternativa de biocontrol para combatir esta enfermedad. Ricos en metabolitos secundarios como los terpenos, que desempeñan un papel decisivo en la defensa de las plantas, estos extractos también contienen ésteres y ácidos grasos. Aunque estos últimos no están clasificados como metabolitos secundarios, contribuyen significativamente a la composición bioquímica de la planta. Nuestro objetivo fue evaluar la eficacia inhibidora in vitro de extractos etanólicos derivados de hojas y tallos de Cnidoscolus urens L. contra Colletotrichum spp. Para lograr esto, se empleó un método de dilución en agar con diferentes concentraciones de extracto. Los resultados mostraron que las concentraciones que oscilaban entre el tratamiento 3 y el tratamiento 8 inhibieron eficazmente el crecimiento del micelio fúngico. Curiosamente, el origen de los extractos, ya sea de hojas o tallos, no mostró ningún impacto diferencial significativo en su actividad inhibidora. Estos conocimientos enfatizan el efecto constante de los extractos de Cnidoscolus urens L. en el estancamiento de Colletotrichum spp. crecimiento, subrayando su potencial como agentes antifúngicos biológicos en la agricultura. Dada la pronunciada eficacia in vitro de los extractos de hojas y tallos, invitan a una mayor exploración como parte de estrategias agrícolas sostenibles para combatir enfermedades importantes como la antracnosis.
Palabras clave
Método de dilución en agar, Metabolitos secundarios, Inhibición In Vitro, Biocontrol de la antracnosis
Citas
- Alarcon, J., D.C. Recharte, F. Yanqui, S.M. Moreno, and M.A. Buendía. 2020. Fertilizar con microorganismos eficientes autóctonos tiene efecto positivo en la fenología, biomasa y producción de tomate (Lycopersicum esculentum Mill). Sci. Agropecu. 11(1), 67-73. Doi: https://doi.org/10.17268/sci.agropecu.2020.01.08
- Álvarez, E., C.A. Ospina, J.F. Mejía de los Ríos, and G.A. Llano. 2004. Caracterización morfológica, patogénica y genética del agente causal de la antracnosis (Colletotrichum gloeosporioides) en guanábana (Annona muricata) en el Valle del Cauca. Fitopatol. Colomb. 28(1), 1-8. Doi: https://cgspace.cgiar.org/handle/10568/44257
- Barnett, H.L., and Hunter, B. B. 1986. Illustrated genera of imperfect fungi. 4th ed. Macmillan Publishing Co., New York, NY.
- Benson, D.A., I, Karsch., D.J. Lipman, J. Ostell, and D.L. Wheeler. 2005. GenBank. NAR. 1(33), 34-38. Doi: https://doi.org/10.1093/nar/gki063
- Carvalho Neto, M.F., R.C.R.G. Gervásio, E.C.C. Araújo, J.C. Almeida, and A.P. Oliveira. 2018. Bioactivity of the organic extracts of Cnidoscolus urens (L.) Arthur (Euphorbiaceae) on the cabbage-caterpillar. Comun. Sci. 9(3), 402-411. Doi: https://doi.org/10.14295/cs.v8i1.2556
- Chaves-Bedoya, G. 2022. Study on Croton sp. genetic diversity in the department of Norte de Santander using the internal transcribed spacer (ITS) region of ribosomal DNA (rDNA). Rev. Colomb. Cienc. Hortic. 16(1), e13592. Doi: https://doi.org/10.17584/rcch.2022v16i1.13592
- Chaves-Bedoya, G. and L. Ortiz-Rojas. 2022. Estudio fitoquímico de Cnidoscolus urens (L.) Arthur procedente de la región de Cúcuta (Colombia). Inf. Tecnol. 33(6), 21-30. Doi: https://doi.org/10.4067/S0718-07642022000600021
- Ciofini, A., F. Negrini, R. Baroncelli, and E. Baraldi. 2022. Management of post-harvest anthracnose: current approaches and future perspectives. Plants 11(14), 1856, Doi: https://doi.org/10.3390/plants11141856
- El Khetabi, A., R. Lahlali, S. Ezrari, N. Radouane, N. Lyousfi, H. Banani, L. Askarne, A. Tahiri, L. El Ghadraoui, S. Belmalha, and E.A. Barka. 2022. Role of plant extracts and essential oils in fighting against postharvest fruit pathogens and extending fruit shelf life: a review. Trends Food Sci. Tech. 120, 402-417. Doi: https://doi.org/10.1016/j.tifs.2022.01.009
- Elhamouly, N.A., O.A. Hewedy, A. Zaitoon, A. Miraples, O.T. Elshorbagy, S. Hussien, A. El-Tahan, and D. Peng. 2022. The hidden power of secondary metabolites in plant-fungi interactions and sustainable phytoremediation. Front. Plant Sci. 13, 1044896. Doi: https://doi.org/10.3389/fpls.2022.1044896
- Figueiredo Junior, E.C., Y.W. Cavalcanti, A.B. Lira, H.L.F. Pessoa, W.S. Lopes, D.R. Silva, I.A. Freires, P.L. Rosalen, E.M.M.B. Costa, and J.V. Pereira. 2021. Phytochemical composition, antifungal activity, in vitro and in vivo toxicity of Syzygium cumini (L.) skeels leaves extract. Bol. Latinoam. Caribe Plantas Med. Aromat. 20(5), 536-557. Doi: https://doi.org/10.37360/blacpma.21.20.5.40
- Kong, W.L., L. Rui, H. Ni, and X.Q. Wu. 2020. Antifungal effects of volatile organic compounds produced by Rahnella aquatilis JZ-GX1 against Colletotrichum gloeosporioides in Liriodendron chinense × tulipifera. Front. Microbiol. 11, 1114. Doi: https://doi.org/10.3389/fmicb.2020.01114
- Martínez-Culebras, P.V. 1999. Caracterización y diagnóstico molecular de las cepas de Colletotrichum patógenas de plantas de fresa. PhD thesis. Universidad de Valencia, Valencia, Spain.
- Panno, S., S. Davino, A.G. Caruso, S. Bertacca, A. Crnogorac, A. Mandić, E. Noris, and S. Matić. 2021. A review of the most common and economically important diseases that undermine the cultivation of tomato crop in the Mediterranean basin. Agronomy 11(11), 2188. Doi: https://doi.org/10.3390/agronomy11112188
- Percival, G.C. and S. Graham. 2021. Evaluation of inducing agents and synthetic fungicide combinations for management of foliar pathogens of urban trees. Arboric. Urban For. 47(2), 85-95. Doi: https://doi.org/10.48044/jauf.2021.008
- Quiroz-Lobo, Y., G. Santafé-Patiño, and J.-A. Quirós-Rodríguez. 2022. Bioactividad e identificación de los ácidos grasos de la esponja marina Tetilla rodriguesi (Tetractinellida: Tetillidae) en el Caribe colombiano. Rev. Biol. Trop. 70(1), 20-29.
- Sepúlveda-Flórez, D.R. 2016. Sistemas de producción de tomate en el municipio de Cáchira, Norte de Santander: en busca de elementos para el análisis de su sostenibilidad. Undergraduate thesis. Pontificia Universidad Javeriana, Bogota.
- Shahriar, S.A., A. Husna, T.T. Paul, M.N.K. Eaty, M. Quamruzzaman, A.B. Siddique, M.A. Rahim, A.N.F. Ahmmed, J. Uddain, and S. Siddiquee. 2023. Colletotrichum truncatum causing anthracnose of tomato (Solanum lycopersicum L.) in Malaysia. Microorganisms 11(1), 226. Doi: https://doi.org/10.3390/microorganisms11010226
- Vaou, N., E. Stavropoulou, C. Voidarou, Z. Tsakris, G. Rozos, C. Tsigalou, and E. Bezirtzoglou. 2022. Interactions between medical plant-derived bioactive compounds: focus on antimicrobial combination effects. Antibiotics 11(8), 1014. Doi: https://doi.org/10.3390/antibiotics11081014
- Waheed, K., H. Nawaz, M.A. Hanif, and R. Rehman. 2020. Tomato. pp. 631-644. In: Hanif, M.A., H. Nawaz, M.M. Khan, and H.J. Byrne (eds.). Medicinal plants of South Asia: novel sources for drug discovery. Elsevier, Doi: https://doi.org/10.1016/B978-0-08-102659-5.00046-X
- Yuan, H., Q. Ma, L. Ye, and G. Piao. 2016. The traditional medicine and modern medicine from natural products. Molecules 21(5), 559. Doi: https://doi.org/10.3390/molecules21050559
